
بوردتلاها و بیماری سیاه سرفه (Whooping cough)
تهیه و تنظیم: دکتر محمد قهری
مقدمه:
گونههای بوردتلا کوکوباسیلهای کوچک، گرم منفی، هوازی اجباری، غیرتخمیرکننده و کاتالاز مثبت هستند که میتوانند اسیدهای آمینه را اکسید کرده اما قندها را تخمیر نمیکنند. چندین گونه بوردتلا وجود دارد. این گونهها در مجاری تنفسی حیوانات خونگرم یافت میشوند. بوردتلا پرتوسیس (Bordetella pertussis) یک باکتری بیماریزای بسیار مسری و مهم در انسان است كه عامل مسبب سیاه سرفه یا پرتوسیس (Whooping Cough) میباشد. بوردتلا پاراپرتوسیس (B.parapertussis) نیز ایجاد بیماری مشابهی مینماید.
این باکتری علاوهبر انسان، برهها را هم آلوده میکند، اما یک پاتوژن غیرشایع انسانی است که ممکن است ایجاد عفونت بدون علامت و یا بیماری سیاه سرفه یا خروسک و اغلب برونشیت نماید. بوردتلا برونشیسپتیكا (B.bronchiseptica) در حیوانات مانند سگ و خرگوش ایجاد بیماری میكند و در انسانهای با ضعف سیستم ایمنی گاهی اوقات بیماری شبیه به سیاه سرفه را سبب میشود. این باکتری اساساً سبب ایجاد سرفه کنل در سگ[۱] میشود. گونه چهارم بوردتلا آویوم تنها پرندگان را آلوده میکند. مطالعات ژنتیکی نشان میدهد که این چهار گونه خیلی به هم نزدیک هستند، بطوریکه بعضی از محققان اعتقاد دارند که آنها چهار زیرگونه در یک گونه بوردتلا هستند. بوردتلا هینزی (B.hinzii) عامل باکتریمی و بیماری تنفسی، بوردتلا هولمسئی (B.holmseii) عامل باکتریمی و بوردتلا تریماتوم (B.trematum) عامل زخم و عفونت گوش میانی هستند. بوردتلا پتری (B.petri) و بوردتلا آنسورپی (B.ansorpii) سبب عفونت در افرادی که ضعف سیستم ایمنی دارند میشوند. بوردتلاها مانند بروسلاها، لیستریاها، مایکوباکتریومها و سالمونلاها باکتری درون سلولی اختیاری هستند و برخی از سویههای آن کپسولدار میباشند. بوردتلاها سختگیر بوده و بهآرامی رشد میکنند. کشت بوردتلا پرتوسیس روی محیط اختصاصی که دارای نشاسته، چارکول (زغال) یا دانههای رزینی جهت حذف اسیدهای چرب و سایر مواد توكسیک تولیدشده در هنگام رشد است صورت میگیرد. مثال از این نوع محیطها محیط بوردت-ژانگو آگار[۲] (حاوی نشاسته سیبزمینی) و ریگان-لو آگار[۳] (حاوی چارکول) است. سایر گونههای بوردتلا (به غیر از بوردتلا پرتوسیس) میتوانند روی شكلات آگار رشد نمایند. بوردتلاها دو تا هفت روز بعد از كشت روی این محیطها، ایجاد کلنیهای ریز و براق میکنند. در جدول ۱ ویژگیهای بیوشیمیایی جهت افتراق گونههای بوردتلا نشان داده شده است.
جدول ۱: ویژگیهای بیوشیمیایی جهت افتراق گونههای بوردتلا

بوردتلا پرتوسیس
این ارگانیسم كوكوباسیل گرم منفی كوچكی شبیه به هموفیلوس آنفلوانزا است و بر روی اپیتلیوم مخاطی مژكدار نازوفارنكس و نای انسان رشد میكند. بوردتلا پرتوسیس بدون حركت است. این باكتری دارای گرانولهای متاكروماتیک در دو قطب سلول و واجد كپسول است. جداسازی اولیه بوردتلا پرتوسیس احتیاج به محیطهای غنیشده دارد، از این رو از محیطهای بوردت-ژانکو (Bordet-Gengou) حاوی آنتیبیوتیک و ریگان-لو آگار (Regan–Lowe agar) (حاوی چارکول) استفاده مینمایند.
این باكتری همانند بوردتلا پاراپرتوسیس و برخلاف سایر بوردتلاها غیرمتحرک بوده و در كشتهای اولیه نیاز به فاكتورهای X و V دارد و در محیطهای خوندار ایجاد همولیز میكند. برخلاف سایر گونهها، بوردتلا پرتوسیس فعالیت اورهآزی نداشته و روی محیط شکلات آگار و سیترات رشد نمیکند. تولید سم پرتوسیس (Pertussis Toxin) بهوسیله بوردتلا پرتوسیس، مهمترین اختلاف بوردتلا پرتوسیس با سایر گونهها است. این سم مسئول بسیاری از علائم و یافتههای پاتولوژیک مرتبط با سیاه سرفه است. بوردتلا پرتوسیس در دمای ۲۸ درجه سانتیگراد و در حضور سولفات منیزیم یا اسید نیکوتینیک در محیط كشت، تغییرات فنوتیپی قابلبرگشتی پیدا میکند و قدرت بیماریزایی آن كاهش مییابد. ایزولههای اولیه بوردتلا پرتوسیس، بسیار بیماریزا و تولیدكننده توكسین هستند، اما سابکالچرهای بعدی منجر به ایجاد و ظهور تیپهای جدید كلنی میگردد كه از نظر میزان بیماریزایی متفاوت هستند. این تغییرات در بیماریزایی، ناشی از تغییرات فاز است. بهطور کلی بوردتلا پرتوسیس دارای ۴ تیپ كلنی یا فاز است. ایزولههای فاز I (ایزولههای تازه) دارای کپسول، پیلی، سمی و بیماریزا هستند. سابکالچرهای بعدی دارای فازهای III ,II ,IV هستند که به تدریج خصوصیات بیماریزایی خود را از دست میدهند. فاز IV بدون كپسول و پیلی و غیربیماریزا است.
پیشگیری از ابتلا به سیاه سرفه
واکسیناسیون با واکسن سهگانه دیفتری، کزاز، سیاه سرفه راه اصلی پیشگیری از بیماری است و بهطور قابل ملاحظهای از شیوع بیماری کاستهاست. واکسنهایی که برای پیشگیری استفاده میشود (واکسنهای سلول کامل؛ واکسنهای بدون سلول) هستند. واکسنهای بدون سلول واکنش ناخواسته کمتر ایجاد میکنند و به اندازه واکسنهای سلول کامل مؤثر هستند. میزان اثر بخشی واکسن بعد از ۴–۱۲ سال کاهش پیدا میکند. به همین دلیل بیماری در سنین نوجوانی و بزرگسالی نیز دیده میشود.

علایم بیماری سیاه سرفه
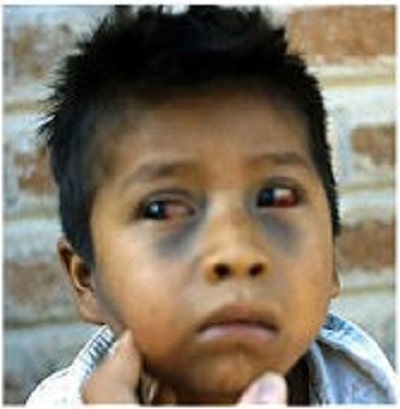
بیماری سیاه سرفه دارای یک دوره کمون ۱۲-۳ روزه میباشد. در این مرحله، باکتری به تکثیر خود ادامه میدهد تا وارد مرحله علامتدار بیماری گردد که با آسیب پوشش مجاری تنفسی همراه است. سیاه سرفه در کودکان معمولا در ۳ مرحله تظاهر میکند که این مراحل همیشه از هم جدا نبوده و مرز مشخصی ندارند. مرحله اول یا نزلهای که مسریترین زمان بیماری هم میباشد، مشابه یک سرما خوردگی بوده و حدود ۲-۱ هفته طول میکشد. در این مرحله بیمار از عطسه، گرفتگی و آبریزش بینی، تب خفیف، اشکریزش و قرمزی چشم و سرفه خشک رنج میبرد. به تدریج سایر علایم تخفیف یافته ولی سرفه شدیدتر شده و حالت حملهای پیدا میکند که نشاندهنده شروع مرحله دوم یا اصلی بیماری به نام مرحله حملهای میباشد که حدود ۶-۲ هفته طول میکشد. حمله سیاه سرفه در کودکان در ابتدا با احساس اضطراب همراه بوده و به دنبال آن، سرفههای شدید و مداوم شروع میشود که تنفس را برای بیمار مشکل میکند. کودک به جلو متمایل شده و صورتش بر افروخته و چشمها پر اشک و زبان به صورت لوله شده خارج میشود و تنفسهای منقطع و کوتاه صدا داری در بین سرفهها شنیده میشود. پس از پایان سرفه، اگر در حدی طولانی نشده باشد که کودک بیهوش گردد، حمله با یک تنفس عمیق و صدا دار به نام هوپ، تمام شده و خلط جدا شده از مجاری تنفسی طی حمله که بلع شده است، با استفراغ دفع میشود. کودک خسته و بیحال میباشد اما بتدریج بهتر میشود. ممکن است دربرخی از افراد، تعداد دفعات سرفه در هر روز کم باشد اما در برخی دیگر تا ۱۰۰ نوبت هم میرسد. میانگین دفعات، تقریبا ۱۲ تا ۱۵ نوبت در هر روز میباشد. بین هر نوبت حمله سرفه، فرد ممکن است سالم به نظر رسد (مگر اینکه عارضهای در بیمار بروز کند). در اثر سرفههای شدید، گاهی خونریزیهای کوچک زیر پوستی (پتشی) در صورت یا در ملتحمه چشم رخ میدهد. اگر عارضهای رخ ندهد، پس از چند هفته شدت و دفعات حملات کاهش مییابد که نشاندهنده شروع مرحله سوم بیماری یا مرحله نقاهت است و ۲ هفته یا بیشتر طول میکشد.
آنتیژنها و فاكتورهای بیماریزایی بوردتلا پرتوسیس
حداقل چهار نوع ادهسین بر روی سطح بوردتلا پرتوسیس یافت میشود و این باکتری تولید چهار توکسین میکند.
(الف) ادهسینها
پرتاكتین[۴]، پیلی، هماگلوتینین رشتهای[۵] و هماگلوتینین-توكسین پرتوسیس[۶]، همگی در سطح باكتری قرار دارند و در شروع و پایداری کلونیزاسیون در نازوفارنكس موردنیاز هستند.
پرتاكتین، یک پروتئین ۶۹ کیلودالتونی است که ابتدا بهصورت پیشساز ۹۳ کیلودالتونی تولید و پردازش شده و در سطح باكتری قرار میگیرد. نشان داده شده كه پرتاکتین اتصال بوردتلا پرتوسیس را به سلولهای Hela و تخمدان هامستر چینی[۷] تسهیل می كند.
فاز I بوردتلا دارای چندین تیپ پیلی است. حداقل دو سروتیپ از پیلی بوردتلا پرتوسیس شناسایی شده که پیلی یا فیمبریه ۲ و ۳ نامیده میشود. بعضی مواقع، محققان به این سروتیپها آگلوتینوژن هم میگویند. احتمالاً پیلی، ادهسین اصلی و كلیدی بوردتلا پرتوسیس نیست، ولی در كشت سلولی حلقه نای[۸] نشان داده شده است كه در اتصال به اریتروسیتهای انسان و سلولهای اپیتلیال مژكدار موردنیاز است. نتایج آزمایشها در موش نشان میدهد که پیلی بوردتلا پرتوسیس نقش مهمی در اتصال بوردتلا پرتوسیس به نای دارد، ولی در اتصال به نازوفارنکس نقشی ندارد.
هماگلوتینین رشتهای (FHA) اصلیترین ادهسین بوردتلا پرتوسیس است. ابتدا FHA بهصورت پیشساز ۳۷۰ کیلودالتونی تولید شده كه در مرحله بعد بهصورت ادهسین FHA220 کیلودالتونی درمیآید. FHA واسطه اتصال به انواع مختلفی از سلولهای کشت داده شده، شامل سلولهای اپیتلیال مژکدار در كشت سلولی حلقه نای است. نتایج آزمایشها در موش نشان میدهد که FHA ادهسین اختصاصی در هر دو ناحیه نازوفارنکس و نای است. همانند جایگاه اتصال پرتاکتین، محل اتصال FHA نیز دارای سكانس Arg-Gly-Asp (سكانس RGD) است. برخلاف سكانس پرتاكتین، این سكانس در FHA بهنظر نمیرسد در تهاجم به سلول دخالت داشته باشد.
FHA دارای سه جایگاه مجزای اتصال است: ناحیه Arg-Gly-Asp به لاكتوزیل سرامید متصل شده و دو ناحیه نامشخص كه جداگانه به هپارین و CR3 (گیرنده ۳ کمپلمان اینتگرین لکوسیت) متصل میشوند. اتصال FHA به CR3 بدلیل تقلید CR3 از گیرنده اندوتلیال است. آنتیبادی ضد FHA به سلولهای اندوتلیال متصل شده و با بسیج لكوسیتها و افزایش نفوذپذیری اندوتلیوم تداخل میکنند. بوردتلا پرتوسیس بواسطه اتصال به گیرنده CR3 موجود در سطح ماكروفاژها به درون آنها راه مییابد. از آنجایی كه باكتری در ماكروفاژ از بین نمیرود در ریه بقا پیدا میکند.
بعضی از مطالعات نشان میدهد که ایمنسازی دهانی و تنفسی موش با FHA خالصشده، آنها را از عفونت ریه و نای با بوردتلا پرتوسیس محافظت میكند. دیگر مطالعات نشان میدهد که ایمونیزاسیون داخل عضلانی یا صفاقی با FHA خالصشده، موشها را از کلونیزاسیون ریه و نای با بوردتلا پرتوسیس محافظت میکند و این اثر حفاظتی ناشی از تولید IgM ,IgG (بیشتر از IgA) علیه FHA است.
توكسین پرتوسیس-هماگلوتینین (TOX-HA) هماگلوتینینی است كه دارای ۵ درصد توانایی اتصالی FHA بوده و از باكتری بوردتلا پرتوسیس به محیط خارج ترشح میشود. بعضی از محققان حدس میزنند که TOX-HA، بواسطه اتصال به سایر پاتوژنهای مخاطی مانند هموفیلوس آنفلوانزا و استرپتوکوک پنومونیه، عفونت ثانویه را در نواحی آلودهشده به بوردتلا پرتوسیس القاء و تسهیل میکند.
(ب) توكسینها
بوردتلا پرتوسیس تولید چهار سم مهم بنامهای پرتوسیس توكسین، آدنیلات سیکلاز پرتوسیس، درمونكروتیک توكسین[۹] و سیتوتوکسین نای[۱۰] میکند.
توكسین پرتوسیس. این سم كلید توانایی بوردتلا پرتوسیس در ایجاد سیاه سرفه است. در حقیقت، سایر گونهها به دلیل نداشتن این سم، بندرت بیماری مشابه سیاه سرفه در انسان ایجاد میکنند.
توكسین پرتوسیس، از نوع توکسین A-B است. زیرواحد A آن (توکسیک) دارای یک زیرواحد S1 است، درحالیکه زیرواحد B (باندینگ رسپتور) دارای دو دایمر است؛ یكی از این دو دایمر دارای زیرواحد S2-S3 و دیگری دارای زیرواحد کمپلکس S2-S4 است. این دو دایمر توسط یک S5 به هم متصل میشوند. مدل A-B یک مدل عمومی برای اگزوتوکسینها است.
شکل ۱ مکانیسم عمل توکسین پرتوسیس را نشان میدهد. بوردتلا پرتوسیس این سم را به محیط بیرون ترشح میکند. زیرواحد B با اتصال به گیرندههای سلولی، سبب ورود زیرواحد A به داخل سلول هدف میشود. در داخل سلول، توكسین با شکستن NAD، سبب اتصال ADP-ریبوزیله به زیرواحد (از پروتئین Gi متصل به غشاء میگردد (پروتئینهایی كه دارای فعالیت گوانوزین تریفسفاتاز هستند، پروتئین G نامیده میشوند. عملكرد Gi مهار یا تنظیم منفی فعالیت یک آدنیلات سیكلاز وابسته به آنها است).
ADP-ریبوزیله، Gi را غیرفعال کرده و آن را از آدنیلات سیكلاز جدا میکند. از آنجایی که در این زمان هیچ مكانیسمی جهت مهار فعالیت آدنیلات سیكلاز وجود ندارد، طی پاسخ به هرگونه افکتوری كه آدنیلات سیكلاز را فعال كند، مقادیر فراوانی cAMP در سلول تجمع مییابد. ترشح و دفع یون کلر در حضور مقادیر فراوان cAMP القاشده و تغییرات در جریان یونی، باعث میگردد تا سلولهای تحت تأثیر، مقادیر فراوانی مایعات و الكترولیت را ترشح نمایند. اگرچه مکانیسم عمل این سم از کلرا توکسین متفاوت است، ولی در نهایت هر دوی آنها سبب تجمع آب و الکترولیت میشوند.
توكسین پرتوسیس یک فاکتور القاکننده لنفوسیتوز[۱۱] و فاکتور حساسکننده به هیستامین[۱۲] است. محققین معتقدند كه توكسین در اثر القاء سنتز اینترلوکین یک سبب لنفوسیتوز میگردد و این امر باعث میشود تا اثر هیستامین در بسیاری از سلولها بارز گردد. توكسین پرتوسیس باعث میشود تا دستگاه تنفسی مقادیر فراوانی از ترشحات موكوئیدی را ترشح نماید و به محرکها بسیار حساس گردد. در این حالت فرد دچار سرفههای شدید حملهای میشود.
بوردتلا پرتوسیس دو نوع آدنیلات سیكلاز دارد؛ یكی از آنها در باكتری باقی میماند و دیگری ترشح میشود. آدنیلات سیكلاز پرتوسیس هم میتواند بهتنهایی و هم بهصورت توأم با ورود باكتری، به درون سیتوپلاسم سلول وارد گردد. در درون سلول میزبان، آدنیلات سیكلاز بوسیله كالمودولین فعال میشود. آدنیلات سیكلاز پرتوسیس فعالشده، سبب فعال شدن درمونكروتیک توكسین میگردد. هرچند نقش آدنیلات سیكلاز باكتری در بیماریزایی مشخص نشده، ولی تحقیقات نشان داده كه سویههای فاقد آدنیلات سیكلاز، غیربیماریزا هستند.
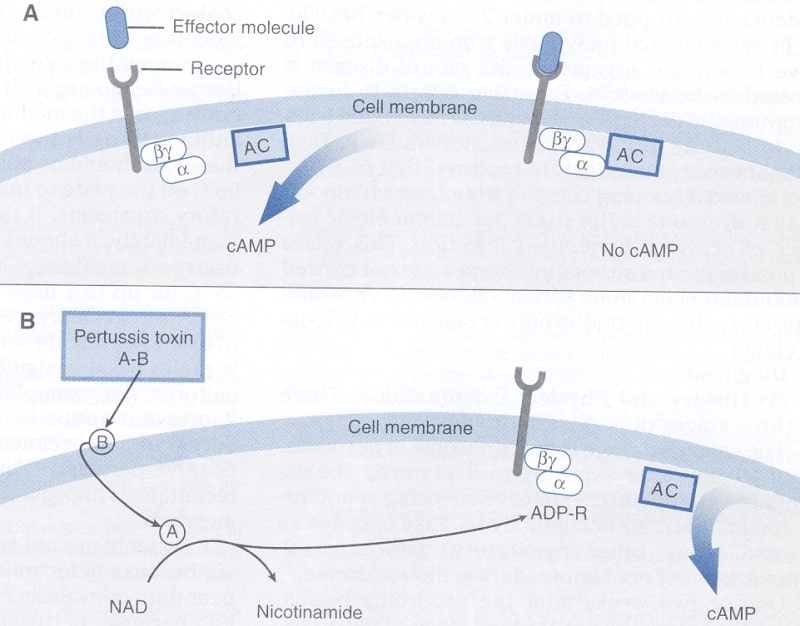
شکل A عملکرد طبیعی زیرواحد α پروتئین Gi را نشان میدهد. بهطور نرمال این زیرواحد به تحریکات خارجی از طریق ارتباط با آدنیلات سیکلاز (AC) باندشده به غشاء پاسخ میدهد. ارتباط فعالیت AC را متوقف میکند. شکل B نشان میدهد که هنگامی که توکسین پرتوسیس وجود دارد، زیرواحد B توکسین به گیرندههای سطحی سلول باند میکند و ورود زیرواحد A را به داخل سلول تسهیل مینماید. زیرواحد A با شکستن نیکوتین آمیدآدنین در نوکلئوتید (NAD)، آدنوزین دی فسفات به اضافه ریبوز (ADP-R) را به زیرواحد پروتئین Gi متصل میکند. پروتئین ADP-ریبوزیله شده Gi از AC همراه خود جدا شده و مقدار زیادی آدنوزین منوفسفات حلقوی (cAMP) به دلیل فعالیت آدنیلات سیکلاز بدون کنترل آزاد میشوند. در نهایت تجمع cAMP، سبب افزایش ترشحات مایعات و الکترولیتها میگردد (برگرفته از کتاب میکروبشناسی پزشکی استوارت واکر).
توكسین درمونكروتیک. که اغلب سم حساس به گرما نیز نامیده میشود، هنگامی که بوردتلا پرتوسیس فاز I لیز میگردد، آزاد میشود. نقش آن در پاتوژنز بوردتلا پرتوسیس دقیقاً اثبات نشده است، ولی این توکسین دارای خاصیت Ciliastatic (آسیب به مژه)، سایتوتوكسیک، نکروز بافتی (درمونکروزیس) و حساس به دمای[۱۳] ۵۶ درجه سانتیگراد است. تزریق درمونكروتیک توكسین بهصورت داخل صفاقی در موش مرگآور است.
سیتوتوکسین نای. یک قطعه ۹۲۱ دالتونی از پپتیدوگلیکان است كه طی رشد باكتری آزاد میگردد. نام دیگر TCTء،acetyleGlucoseAminyl-1,6-anhydromuramylalnyl-g-Glutamyldiaminopimelyalanineء-N است. TCT و مورامیل پتپیدهای همراه آنها، دارای فعالیتهای تغییردهنده سیستم ایمنی[۱۴]، Ciliostatic (همانند درمونكروتیک توكسین) و Ciliocidal هستند. همچنین این مولکولها از اتصال هیدروكسی تریپتامین به گیرندههای سلولی جلوگیری میکنند و مهمتر آنكه در سلولهای مژهدار از سنتز DNA ممانعت به عمل میآورند.
بوردتلا پرتوسیس در حلق، بینی و خلط بیماران و در حیوانات یافت میشود و از طریق تنفسی میزبان انسانی خود را آلوده میکند. این باکتری دارای هیچ ناقلی نیست و به خون همانند ویبریوکلرا تهاجم ندارد و سبب سپتیسمی یا باکتریمی نمیگردد. در افراد غیرواکسینه که با بوردتلا پرتوسیس مواجه میشوند، میزان بروز بیماری ۹۰ تا ۹۵ درصد گزارش شده است. تلاشهای وسیع برای یافتن افراد ناقل بوردتلا پرتوسیس کاری بیفایده است. نتیجه مطالعه روی افراد غیرواکسینه در دانمارک نشان داد که ۶۱ درصد افراد در دوران کودکی خود، سیاه سرفه را تجربه کردند، بطوریکه همه افراد در بررسی ایمنولوژیک، ابتلای قبلی به بوردتلا پرتوسیس را نشان میدادند. این مطالعه این حدس را قوی کرد که اگرچه بوردتلا پرتوسیس ناقل بدون علامت ندارد، ولی در بعضی از افراد، سبب بیماری تنفسی شده که بهعنوان سیاه سرفه شناسایی نمیگردد.
مراحل بیماریزایی بوردتلا پرتوسیس
بوردتلا پرتوسیس یک باکتری Viscerotropic است که گرایش زیادی به سلولهای مژهدار اپیتلیال دارد. بوردتلا پرتوسیس به کمک FHA، پیلی و پرتاكتین به سلولهای نازوفازنكس و نای متصل میشود. اغلب باکتریها هنگامی که توسط ماکروفاژها فاگوسیت میشوند به برونش میرسند. بعضی از باکتریها در داخل ماکروفاژها و سلولهای اپیتلیال تکثیر مییابند، اما بیشتر تغییرات پاتولوژیک ناشی از باکتریهای خارج سلولی است که به اپیتلیوم سلولهای مژهدار متصل میشوند.
علائم سیاه سرفه، ناشی از تولید توکسین توسط بوردتلا پرتوسیس است. توکسین پرتوسیس سبب افزایش ترشحات و همچنین سبب حساس شدن مخاط به هیستامین میگردد. درمونکروتیک توکسین و TCT سبب از بین رفتن اپیتلیوم مژهدار و کاهش توانایی مژهها در پاک کردن باکتریها و ترشحات از دستگاه تنفسی میشود. در بیمار، آسیب نازوفارنکس بهصورت تحریکپذیری و عطسه مکرر ظاهر میشود. در حضور عامل القاکننده هیستامین (مانند وجود آلرژن و عفونتهای ویروسی)، حساسیت زیاد به هسیتامین سبب افزایش ترشحات و اسپاسم میگردد. در نهایت، تمام سطح اپیتلیوم مژهدار توسط ترشحات زیاد و چرکی پوشانیده میشود. اثرات ترکیبی ترشحات، حساسیت به هیستامین و نکروز سبب حملات وحشتناک سرفه در فرد بیمار میگردد.
عموماً سیاه سرفه در ایالات متحده آمریکا، در نوجوانان (بیشتر موارد در افراد بالای یک سال) مشاهده میشود. در طی دهه ۵۰ میلادی میزان بروز سیاه سرفه در حدود ۲۳ در ۱۰۰/۰۰۰ نفر بود. با بهکارگیری واکسن سیاه سرفه این میزان کاهش و به ۲ مورد در ۱۰۰/۰۰۰ نفر رسید. در سال ۲۰۱۲ بیش از ۴۸ هزار مورد بیماری سیاه سرفه به CDC گزارش گردید که بیشترین تعداد موارد از سال ۱۹۵۵ در ایالات متحده آمریکا بود. یک همهگیری گسترده با ۱۰ هزار مورد به تنهایی در سال ۲۰۱۴ در کالیفرنیا گزارش گردید که اغلب در افراد غیرواکسینه بود. سیاه سرفه در بزرگسالان بهآسانی قابل تشخیص نیست اما نشانههایی وجود دارد که نشان میدهد تعداد موارد بیماری در بزرگسالان همانند کودکان در حال افزایش است.
در افراد غیرواکسینه که با بوردتلا پرتوسیس مواجه میشوند، میزان بروز بیماری ۹۰ تا ۹۵ درصد گزارش شده است. تلاشهای وسیع برای یافتن افراد ناقل بوردتلا پرتوسیس کاری بیفایده است. نتیجه مطالعه روی افراد غیرواکسینه در دانمارک نشان داد که ۶۱ درصد افراد در دوران کودکی خود، سیاه سرفه را تجربه کردند، بطوریکه همه افراد در بررسی ایمنولوژیک، ابتلای قبلی به بوردتلا پرتوسیس را نشان میدادند. این مطالعه این حدس را قوی کرد که اگرچه بوردتلا پرتوسیس ناقل بدون علامت ندارد، ولی در بعضی از افراد، سبب بیماری تنفسی شده که بهعنوان سیاه سرفه شناسایی نمیگردد.
واژهنامه:
| Regan – Lowe agar | [۳] | Bordet – Gengou agar | [۲] | Kennel cough in dogs | [۱] |
| Pertussis Toxin Hemagglutinin | [۶] | Filamentous Hemagglutinin (FH) | [۵] | Pertactin | [۴] |
| Dermonecrotic Toxin | [۹] | Tracheal Ring | [۸] | Chinese Hamster Ovary Cell | [۷] |
| Histamine-Sensitizing Factor | [۱۲] | Lymphocytosis-Promoting Factor | [۱۱] | Tracheal Cytotoxin (TCT) | [۱۰] |
| Immunomodulating | [۱۴] | Heat-Labile | [۱۳] |





خیلی عالی بود.ممنون از زحماتتون.قطعا کامل ترین مطلبی که درمورد بوردتلاها میشد پیدا کرد همینه