تشخیص آزمایشگاهی مايكوباكتريوم ها (۱): نمونههای خلط و ترشحات دستگاه تنفس
تهیه و تنظیم: دكتر محمد قهری
تشخیص آزمایشگاهی:
بعد از تست پوستی و رادیوگرافی قفسه سینه، جدا كردن و تشخیص میکروبیولوژیکی باسیل كخ روش قطعی در تشخیص بیماری است.
نمونهبرداری:
نمونهبرداری صحیح، فاکتور اصلی در كمک به تشخیص سریع و قطعی بیماری است، ازاینرو كاركنان (پزشک، پرستار و …) باید توجه كافی به این مسئله داشته باشند. نمونهها شامل خلط، چرك غدد، مایع جنب، مایع صفاق، مایع مفصلی، مایع نخاع، خون، ادرار، شیره معده، ضایعات جلدی، بیوپسی از بافت پریکارد و غشای خارجی قلب، اندومتر، لوله فالوپ و مدفوع، برای بررسی باسیل سل هستند.
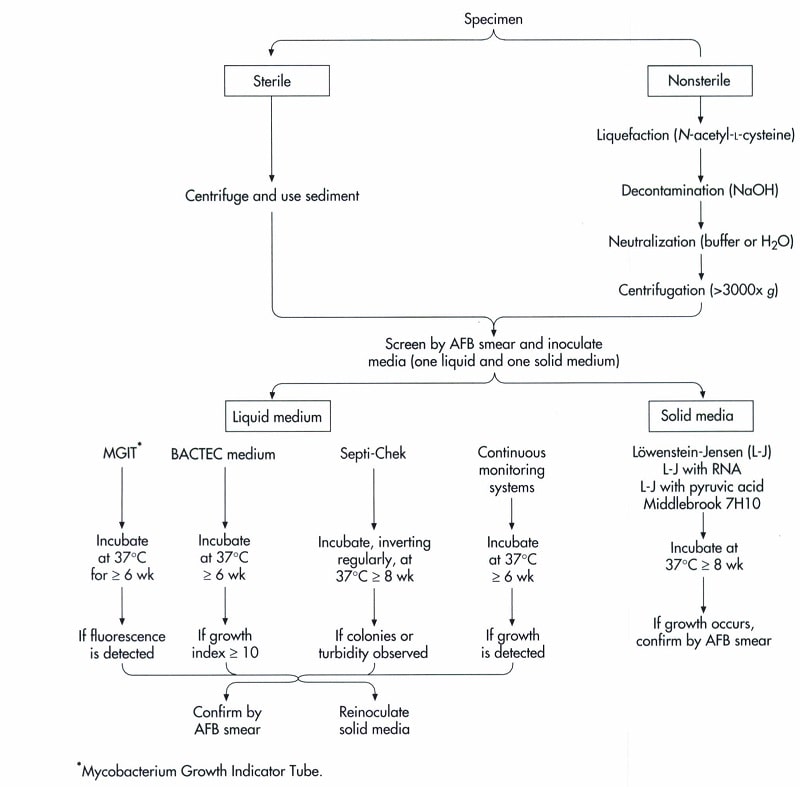
در شکل زیر فلوچارت مرحلهای نمونهها و تشخیص مایکوباکتریومها نشان داده شده است.
تهیه نمونه خلط:
نمونه خلط در هنگام صبح و پس از برخاستن از خواب پس از ۳-۲ بار شستشوی دهان جمعآوری میشود. بیمار باید در هوای آزاد درحالیکه روبروی او کسی قرار ندارد با سرفههای عمیق درصدد تهیه خلط برآید. در گذشته که خلط ۲۴ ساعته جمعآوری میگردید، از آن جهت به تشخیص كمک میكرد كه تعداد بیشتری باسیل دفعشده مورد آزمایش قرار میگرفت، ولی در عوض احتمال آلودگی به انواع باكتریها و قارچها افزایش یافته و سبب كند شدن تشخیص و ایجاد خطا میگردید. ازاینرو بهتر است خلط صبحگاهی را به مدت چند روز متوالی از بیمار جمعآوری و مورد آزمایش قرار داد. نمونه را در ظرف دهانگشاد از جنس پروپیلن یا پلیاتیلن، تمیز و استریل جمعآوری نموده و درب آن را بسته به آزمایشگاه ارسال نمایید. باید توجه داشت که حداقل میزان نمونه ۵ میلیلیتر باشد. لازم به ذکر است که از افرادی که خلط کمی دارند باید نمونه با شستشوی برونش و لاواژ برونکوآلوئولار (BAL) تهیه گردد. بهتر است نمونهها پس از انتقال به آزمایشگاه، سریع کشت داده شوند یا از آنها اسمیر تهیه شود، ولی وقتی امکان آن وجود ندارد، میتوان نمونه را برای کشت حداقل ۳ روز و برای تهیه اسمیر ۱۰ روز نگهداری نمود.
پس از انتقال نمونه خلط به آزمایشگاه بایستی باکتریهای مزاحم را در نمونه با روش هموژنیزاسیون از بین برد و برای افزایش تعداد باسیل سل آن را تغلیظ نمود. در ادامه روشهایی برای نمونههای مختلف توضیح داده میشود.
روش تغلیظ نمونه خلط با ان-استیل-ال سستئین (NALC)-هیدروکسید سدیم (سود):
در مواردی که تعداد باسیلها در خلط کم است و بهوسیله آزمایش مستقیم مشاهده نمیشوند، با استفاده از ان-استیل-ال سستئین (NALC)-هیدروکسید سدیم (سود) ۲% نمونه را تغلیظ نمایید. برای این کار:
- حجم مساوی از ان-استیل-ال سستئین (NALC)-هیدروکسید سدیم (سود) ۲% و خلط (حدود ۱۰ میلیلیتر از هرکدام) را در شیشه درپیچدار بریزید و درب شیشه را محکم ببندید. توجه داشته باشید محلول ان-استیل-ال سستئین (NALC)-هیدروکسید سدیم (سود) موقع استفاده در همان روز تهیه گردد.
- روی دستگاه همزن به مدت ۳۰-۱۵ ثانیه مخلوط گردد.
- به مدت ۱۵ دقیقه نمونه را در لولههای حاوی گلولههای شیشهای قرار داده و بهشدت تکان دهید و آن را مخلوط نمایید.
- افزودن ۲۰ میلیلیتر از بافر فسفات (pH= 8/6) به لولهها و بستن درب لولهها و سروته کردن برای مخلوط شدن نمونهها
- نمونه را به مدت ۱۵ دقیقه با دور ۳۰۰۰ تا ۳۶۰۰ سانتریفوژ کنید. میتوان در دور ۲۵۰۰ به مدت ۲۰ دقیقه سانتریفوژ کرد.
- از رسوب برای تهیه اسمیر جهت رنگآمیزی و تلقیح به محیط کشت استفاده شود.
روش تغلیظ نمونه خلط با سود:
در مواردی که تعداد باسیلها در خلط کم است و بهوسیله آزمایش مستقیم مشاهده نمیشوند، با استفاده از سود ۳% نمونه را تغلیظ نمایید. برای این کار:
- حجم مساوی از سود ۳% و خلط (حدود ۱۰ میلیلیتر از هر کدام) را در شیشه درپیچدار بریزید و درب شیشه را محکم ببندید.
- به مدت ۱۵ دقیقه نمونه را در لولههای حاوی گلولههای شیشهای قرار داده و بهشدت تکان و آن را مخلوط نمایید.
- نمونه را به مدت ۱۵ دقیقه با دور ۳۰۰۰ سانتریفوژ کنید.
- مایع رویی را دور ریخته و به رسوب باقیمانده آنقدر اسید معرفدار اضافه نمایید تا رنگ آن از قرمز به زرد برگردد، سپس نمونه را کشت دهید.
طرز تهیه اسید معرفدار
۱- محلول الف: ۰/۴ گرم فنل را در ۱۰۰ سیسی سود ۳% حل کنید.
۲- محلول ب: ۸۵ سیسی اسید کلرئیدریک غلیظ
محلول اسید معرفدار: به ۵۰۰ سیسی آب مقطر، ۲۰ سیسی از محلول الف و ۸۵ سیسی اسید کلریدریک غلیظ اضافه نمایید سپس حجم را به یک لیتر برسانید.
تشخیص آزمایشگاهی
رنگآمیزی ذیل-نلسون:
روش تهیه رنگ:
- فوشین بازی ۳ گرم
- اتانول ۹۵-۹۰% mlء۱۰
- فنل ۵% (ذوب شده) mlء۹۰
فوشین را در الکل حل کنید. فنل را بهآرامی در آب حل نمایید و ۲ محلول را با هم اضافه نمایید. بهتر است محلول یک شب در ۳۷ درجه سانتیگراد باقیمانده و سپس از کاغذ صافی عبور داده شود.
محلول رنگبر:
- اسید کلرئیدریک mlء۳
- اتانول ۹۵-۹۰% ml ء۹۷
رنگ زمینه:
- متیلن بلو ۰/۳ گرم
- آب مقطر ml ء۱۰۰
روش رنگآمیزی ذیل-نلسون
۱- پس از تهیه گسترش (ابتدا مقداری از نمونه خلط را بر روی لام قرار داده سپس لام دیگری را بر روی لام اول نهاده و در جهت عكس یکدیگر كشیده تا دو عدد گسترش تهیه شود) و پس از خشک شدن، لام دارای گسترش مجهول را توسط المنت حرارتی و در شرایط بسته (داخل فور ۷۰-۶۰ درجه) فیکس نمایید تا از انتشار باکتری به اطراف و آلوده شدن پرسنل جلوگیری شود (فیكساسیون لام قبل از رنگآمیزی توسط المنت حرارتی در داخل فضای بسته _ مانند فور _ صورت میگیرد، زیرا شعله سبب انتشار باسیلها در فضا و آلودگی محیط كار میشود). ازاینرو كار باید زیر هود و در شرایط ایمنی صورت گیرد. ایــــن روش سریع و اختصاصی بوده ولی حساسیت آن از كشت كمتر است (۴۳-۲۵%) و به تعداد باسیل، تكنیک رنگآمیزی، سابقه كار تكنسین و… بستگی دارد.
۲- لام را بر روی پل رنگآمیزی قرار دهید.
۳- یک عدد کاغذ صافی به ابعاد ۲ در ۳ سانتیمتر بر روی گسترش قرار دهید.
۴- رنگ ذیل-نلسون (فوشین بازی) را بر روی کاغذ صافی و گسترش بریزید.
۵- سپس پنبه آغشته به الکل را با پنس برداشته، با شعله روشن نموده و در زیر لام قرار دهید تا رنگ، گرم شده و بخار کند (دقت نمایید که رنگ به جوش نیاید، زیرا سبب رسوب رنگ و عدم مشاهده صحیح نمونه خواهد شد). این کار را برای ۵ دقیقه ادامه دهید.
۶- کمی صبر کنید تا لام خنک شود، سپس آن را با آب شستشو دهید.
۷- لام را در ظرف اسید-الکل (اتانول ۹۵% به اضافه اسید کلرئیدریک ۳%) برای مدت ۱ تا ۲ دقیقه رنگبری نمایید.
۸- رنگ متیلن بلو را بر روی لام برای مدت ۱ دقیقه بریزید.
۹- لام را خشک نموده، توسط میکروسکوپ با عدسی روغنی به مشاهده آن بپردازید. در این مرحله مایکوباکتریومها قرمز رنگ و زمینه، بقیه باکتریها و سایر ترکیبات موجود در لام به رنگ آبی روشن دیده میشوند.
۱۰- لامهای کنترل مثبت (آمپول واکسن BCG) و منفی (استافیلوکوک) را همزمان رنگ کرده و آزمایش نمایید.
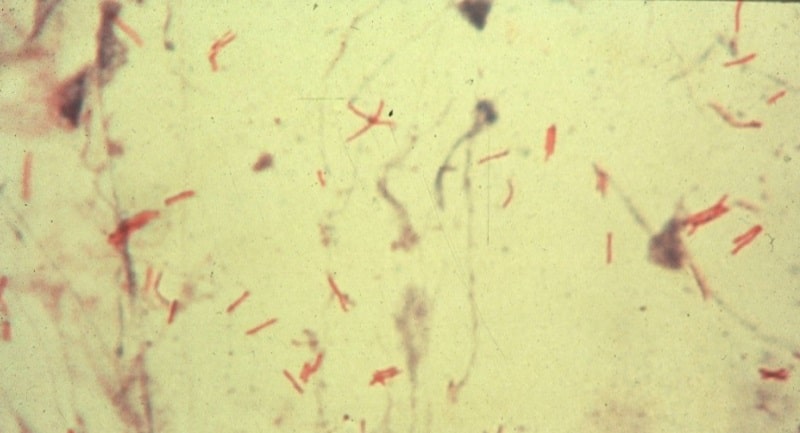
در این روش رنگ فوشین با حرارت جذب باكتری شده (حرارت موم و چربی را حل نموده تا رنگ نفوذ نماید) و سپس اسید-الكل، رنگ را از زمینه و تمام اجسام میكروبی موجود در نمونه، سلولهای اپیتلیال، گلبولهای سفید و غیره بهجز باسیل سل برمیدارد. در این صورت فقط باسیل سل به رنگ قرمز دیده میشود و زمینه بیرنگ است و با ریختن رنگ متیلن بلو زمینه گسترش (مجموعه سلولهای اپیتلیال، موكوس، گلبول سفید و بقیه اجسام میكروبی) به رنگ آبی درمیآیند.
روش گزارش لام اسید–فست
در جدول زیر روش گزارشدهی لام رنگآمیزیشده با دو روش کربول فوشین و فلوروکروم ارائه شده است:
| جدول ۱: دستورالعمل گزارش اسمیر برای باسیل اسید-فست | ||
| تعداد باسیل اسید-فست با رنگآمیزی فلوروکروم (X450) | تعداد باسیل اسید-فست با رنگآمیزی کربول فوشین (X1000) | گزارش |
| ۰ | ۰ | عدم مشاهده باسیل اسیدفست |
| ۱-۲ باسیل در ۷۰ میدان میکروسکوپی (فیلد) در ۲ بار رفت و برگشت | ۱-۲ باسیل در ۳۰۰ میدان میکروسکوپی (فیلد) در ۳ بار رفت و برگشت | مشکوک، بررسی مجدد و نتیجه گزارش شود |
| ۲-۱۸ باسیل در ۵۰ میدان میکروسکوپی (فیلد) در ۱ بار رفت و برگشت | ۱-۹ باسیل در ۱۰۰ میدان میکروسکوپی (فیلد) | نادر، +۱ |
| ۴-۳۶ باسیل در ۱۰ میدان میکروسکوپی (فیلد) | ۱-۹ باسیل در ۱۰ میدان میکروسکوپی (فیلد) | کمی، +۲ |
| ۴-۳۶ باسیل در ۱ میدان میکروسکوپی (فیلد) | ۱-۹ باسیل در ۱ میدان میکروسکوپی (فیلد) | تعدادی، +۳ |
| ۳۶ باسیل یا بیشتر در ۱ میدان میکروسکوپی | ۹ باسیل یا بیشتر در ۱ میدان میکروسکوپی | +۴ |
نکات مهم در رنگآمیزی
- اگر تعداد غیرواقعی از باسیل در اسمیر مشاهده شد و کشت منفی بود باید موارد زیر مجددا چک شوند:
- آلودگی مخازن آبی با ارگانیسمهای اسید فست
- تمیزی اسلایدها
- آلودگی احتمالی روغن امرسیون
- رنگ زمینه قوی ممکن است وجود باسیل را مخفی نماید، لذا بهتر است بجای متیلنبلو از برلیان گرین که زمینه را شفافتر میکند، استفاده شود.
- ارگانیسمهای اسیدفست عبارتند از: ردوکوکوس، نوکاردیا، لژیونلا میکددی، کیست کریپتوسپوردیوم
- نمیتوان تنها به نتایج اسمیر تکیه کرد و گزارش داد، بلکه علاوهبر نتایج اسمیر نتایج کشت هم بایستی گزارش گردد.
فاکتورهایی که حساسیت نتایج اسمیر را تحت تأثیر قرار میدهند شامل:
- جمعیت بیمار (بیماران با لزیونهای غاری شکل از افراد بدون غار احتمال بیشتری برای خلط اسمیر مثبت دارند).
- نوع نمونه (نمونههای تنفسی با احتمال بیشتری نسبت به سایر نمونهها مثبت میشوند).
- تعداد نمونههای آزمایششده
- تعداد باسیل اسیدفست موجود در نمونه (به ازای هر میلیلیتر از نمونه تعداد ۵۰۰۰-۱۰۰۰۰ ارگانیسم نیاز است تا نتیجه مثبت شود).
- گونههای حاضر در نمونه (نمونههای حاوی مایکوباکتریوم توبرکلوزیس یا مایکوباکتریوم کانزانسی با احتمال بیشتری از سایر مایکوباکتریوم ها مثبت میشوند).
- مهارت کارشناس
- رنگ مورد استفاده (رنگهای فلورکروم نسبت به رنگهای کربول فوشین حساسیت بالایی داشته و راحتتر قابل مشاهده هستند و توسط متخصصان CDC توصیه شدهاند. همچنین CDC پیشنهاد میکند که برای نمونههای تخصصی، نتایج اسمیرهای رنگآمیزی شده در طی ۲۴ ساعت از نمونهگیری بایستی گزارش شوند؛ به این منظور در هر ۷ روز هفته پردازش نمونهها صورت گیرد.
کشت:
بهمنظور بازیابی مناسب مایکوباکتریوم از نمونههای بالینی، تلقیح به هر دو محیط مایع و جامد توصیه شده است، محیط مایع خیلی حساستر از محیط جامد است و شناسایی سریع رشد مایکوباکتریومها را فراهم میکند. مهمترین مزیت کشت روی محیطهای جامد این است که این کار امکان تشخیص مورفولوژی کلنیها و تولید پیگمان را میدهد که به تشخیص بهویژه افتراق کلنیهای مایکوباکتریوم توبرکلوزیس از بعضی مایکوباکتریوم غیرسلی کمک میکند. معایب محیطهای جامد مرسوم شامل مدت زمان طولانی برای رشد مایکوباکتریومها (کلنیها اغلب بر روی محیط جامد لولهای زودتر از ۴-۳ هفته مشاهده نمیشود) و حساسیت پایین آنها است. تلقیح به محیط جامد میدلبروک بر روی پلیتها که بعداً در زیر میکروسکوپ بررسی میشوند، اجازه شناسایی سریع کلنیها را میدهد، اما این پروسه بهزحمت فراوان و نیروی انسانی زیادی نیاز دارد، بنابراین در بیشتر آزمایشگاههای بالینی منع استفاده دارد.
برای کشت مایکوباکتریومها از پلیت، لولههای درپیچدار و فلاسکها استفاده میشوند. فلاسکها به دلیل ایمنی بیشتر و فراهم کردن سطح بیشتری برای رشد مایکوباکتریومها به لولههای درپیچدار و پلیتها ترجیح داده میشوند.
محیط لازم برای کشت اولیه مایکوباکتریومها باید شامل یک محیط غیرانتخابی و یک محیط انتخابی باشد؛ محیط انتخابی حاوی آنتیبیوتیکهایی مانند [مالاشیت گرین g/100mlء۰/۰۰۲۵، لینکومایسین (۲μg/ml)، سیکلوهگزامید (۳۶۰μg/ml)، نالیدیکسیک اسید (۳۰μg/ml-ء۲۰)، کربنی سیلین (۵۰μg/ml)، پلیمیکسین Bء(۲۰۰U/ml)، تریمتوپریم (۲۰μg/ml)، آمفوتریسین Bء(۱۰μg/ml)]، جهت جلوگیری از رشد بیش از حد سایر باکتریها و قارچهای آلودهکننده است. سه فرمول عمومی وجود دارند که میتوانند هم برای محیطهای کشت انتخابی و هم غیرانتخابی مورد استفاده قرار گیرند که شامل محیطهای زیر است:
۱- محیط آگار نیمهمصنوعی (مانند میدلبروک ۷H10 و ۷H11). از این محیطها بیشتر برای مشاهده شکل کلنیها و آزمایش حساسیت باکتریها استفاده شده و با افزودن برخی آنتیبیوتیکهای فوق انتخابی میشوند.
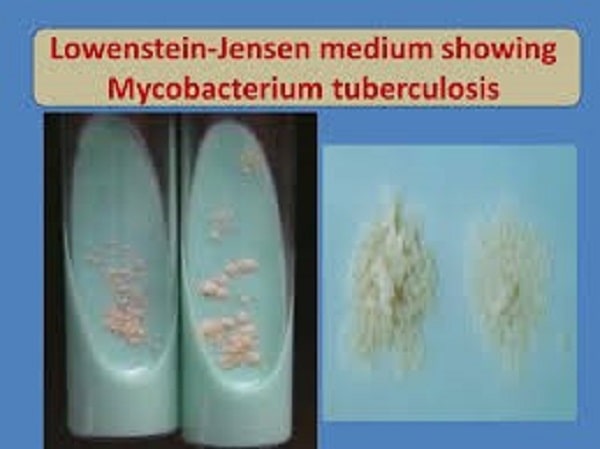
۲- محیط تخممرغ سفتشده (مانند لوین اشتاین جانسون). این محیط که بیشتر در کشور ما استفاده میشود، با افزودن آنتیبیوتیک انتخابی میگردد. اگر نمونه کم باشد، ۶-۳ هفته وقت لازم است تا روی آن کلنی ظاهر شود (شکل ۳ و ۴).
۳- محیط آبگوشتی (میدلبروک ۷H9 و ۷H12). محیطهای انتخابی آبگوشتی حساسترین روش جهت جداسازی است و خیلی سریعتر از سایر محیطها جواب میدهد.
نمونهها را میتوان با لوپ، سواب، پیپت پاستور، نوک سمپلر و غیره کشت داد. پس از محکم کردن درب لوله کشت، باید یک هفته در وضعیت شیبدار قرار گیرد تا با پخش شدن ماده تلقیحشده، رشد یکنواختی حاصل شود. انکوباسیون بایستی در ۱۱-۳% CO2 انجام شود. گرچه در آزمایشگاههای ما معمولاً این اصل به علت کمبود انکوباتورهای CO2دار نادیده گرفته میشود، ولی میتوان از جارهای بیهوازی با روشن کردن شمع، محیط CO2 موردنظر را تأمین کرد. هرچند که بدلالیل نامعلوم، مایکوباکتریها در جارهای بیهوازی بهخوبی رشد نمیکنند.
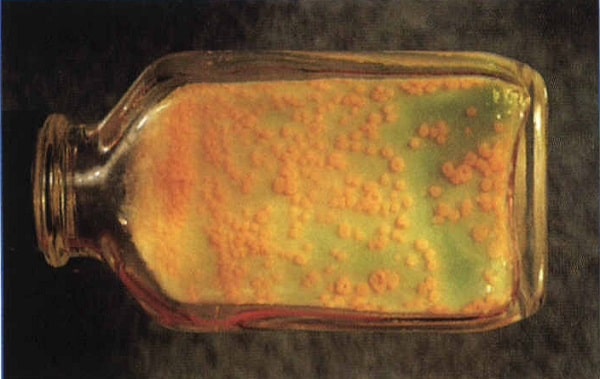
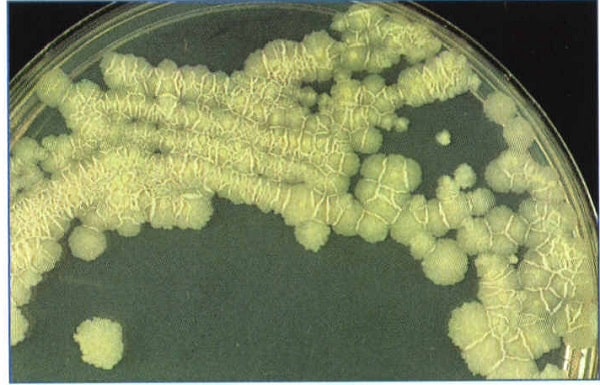
بررسی لولههای کشت: حداقل هر هفت روز یکبار به مدت هشت هفته باید محیط کشت را از نظر کلنی بهوسیله ذرهبین بررسی نمود.
| گزارش رشد | |
| تعداد کلنی مشاهدهشده | گزارش |
| هیچ کلنی | منفی |
| کمتر از ۵۰ کلنی | ذکر تعداد کلنی |
| ۵۰-۱۰۰ کلنی | +۱ |
| ۱۰۰-۲۰۰ کلنی | +۲ |
| ۲۰۰-۵۰۰ کلنی | +۳ |
| بیش از ۵۰۰ کلنی | +۴ |
نکته: در سالهای اخیر بدلیل استعمال نادرست از داروهای ضدسلی، متابولیسم باکتری عامل سل، طوری تغییر یافته است که پس از هموژنیزه کردن خیلی کند رشد میکنند و گاهی هم رشد نمیکنند، به همین جهت توصیه میشود که:
اولاً هرقدر ممکن است زمان هموژنیزاسیون را کوتاه کنید و ثانیاً لولههای کشت را مدت زیادتری در انکوباتور آزمایشگاهی قرار دهید.
كشت و تشخیص سریع:
معمولترین سیستم كشت سریع مایکوباکتریوم توبركلوزیس که اغلب امروزه مورد استفاده قرار میگیرد، سیستم بک تک (BACTEC) است که چندین نوع از این سیستمهای جداسازی اتوماتیک در دسترس است. در یک سیستم بک تک از میدلبروک ۷H12 حاوی سوبسترای اسید پالمتیات نشاندار با C14 استفاده میشود. مایکوباکتریوم توبركلوزیس در عرض ۱۰ تا ۱۴ روز در این سیستم رشد میکند، سپس از روی این سیستم به محیط BACTEC-NAP برای ۷ روز بعد منتقل میشود (مجموعاً ۷ تا ۲۱ روز). در این محیط با استفاده از ρ-نیترو-a-استیل آمینو-b-هیدروكسی پروپیوفنون (NAP) رشد باكتری متوقف میشود. از طرف دیگر، با DNA پروب، نمونههای محیط BACTEC كه بهعنوان مایکوباکتریوم توبركلوزیس شناخته شدهاند را بهسرعت میتوان در ۲ تا ۸ ساعت بعد از جداسازی تشخیص داد (جمعاً ۱۰ تا ۱۵ روز). استفاده از بک تک، زمان لازم برای شناسایی مایکوباکتریوم توبركلوزیس را از ۳ تا ۵ هفتهای كه برای روشهای معمول (مثل محیط لوین اشتاین جانسون) لازم است، كاهش میدهد، همچنین از این سیستمها میتوان برای تعیین حساسیت سریع مایکوباکتریومها اقدام کرد. معایب این سیستمها گرانقیمت بودن آنها، مشاهده نکردن کلنیها روی آن، آلودگی با سایر مایکوباکتریومها، مشکلات در دفع مواد رادیواکتیو و استفاده زیاد از سوزن است.
در آزمایشگاههایی که برای کشت مایکوباکتریومها تعداد درخواستهای کمی دارند، لولههای MGIT که بهصورت دستی خوانش میشوند و میتوانند برای کشت همه انواع نمونهها بهاستثنای خون و ادرار مورد استفاده قرار گیرند، ممکن است مقرون بهصرفهترین انتخاب برای آزمایش باشند. این لولهها حاوی محیط مایع ۷H9 اصلاحشده و یک اندیکاتور فلوئورسنت تعبیهشده در یک سیلیکون در ته لوله هستند. لولهها با نمونهها تلقیح شده و یک مخلوط آنتیبیوتیکی برای مهار رشد باکتریهای آلودهکننده و یک غنیکننده رشد مایکوباکتریومی نیز افزوده میشود و در لولهها بسته شده و در دمای ۳۷ درجه سانتیگراد به مدت ۶ هفته انکوبه میشوند. برای ردیابی رشد مایکوباکتریومها، لولهها بهصورت دستی بر روی ترانسلومیناتور با طولموج ۳۶۵ نانومتر فرابنفش یا در مقابل لامپ WOOD قرار داده میشوند. ظاهر شدن فلوئورسنس قوی در سنسور (یک رنگ نارنجی روشن در ته لوله و هلال سطحی) نشاندهنده رشد باکتری است. برای آزمایشگاههایی با تعداد بالای درخواستها، دستگاه تمام اتوماتیک BACTEC960 که بهصورت پیوسته لولهها را از نظر فلوئورسانس و سیگنال برای آنهایی که مثبت شدهاند چک میکند، مناسب است.
علاوهبر BACTEC و MGIT، دو سیستم دیگر اتوماتیک برای رشد و شناسایی مایکوباکتریومها در نمونهها بهصورت تجاری در دسترس هستند؛ سیستم MB/BACT و VersaTrek. در هرکدام از سیستمها بطریها با نمونهها، یک مخلوط آنتیبیوتیکی و یک مکمل رشد تلقیح میشوند. سیستم MB/BACT یک نوع بطری برای نمونه خون و یک نوع بطری دیگر برای سایر نمونهها دارد. در مرحله بعد بطریها در دستگاه مربوطه انکوبه میشوند؛ جایی که بطریها از نظر تغییرات در تولید و مصرف گازهای مختلف که نشاندهنده رشد مایکوباکتریومها یا سایر ارگانیسمها است، کنترل میشوند. بهطور کلی این سیستمها بهطور قابلمقایسهای با BACTEC960 عمل میکنند و مزیتهای تمام اتوماتیک بودن را دارا هستند؛ بنابراین زحمت کمتر و نیروی انسانی کمتری نیاز دارند و غیررادیومتریک نیز هستند.