روشهای بیوشیمیایی شناسایی انتروباکتریاسهها (۴): شیگلا
ترجمه و تنظیم: دکتر محمد قهری
جنس شیگلا (Shigella genera)
جنس شیگلا (Shigella) عموما به همراه سالمونلا و یرسینیا در دسته پاتوژنهای لاكتوز منفی قرار میگیرند، ولی با توجه به همولوژی DNA، شیگلا و اشریشیا کلی بسیار به هم نزدیك هستند و بعضی از محققین معتقدند كه شیگلا یك زیرگونهی اشریشیا کلی است. گونههای شیگلا از اشریشیا کلی بهواسطه عدم تخمیر لاكتوز، عدم تحرك، عدم فعالیت دكربوكسیلاسیون لیزین و عدم تولید گاز از تمام كربوهیدراتها قابل شناسایی میباشند. گونههای شیگلا از گونههای سالمونلا بهواسطه عدم تحرك و عدم تولید گاز H2S متمایز میشوند.
شیگلاها باسیلهائی به ابعاد ۳-۲×۰/۷-۰/۵ میکرون، بیحرکت، فاقد اسپور و فاقد کپسول، و هوازی بیهوازی اختیاری میباشند. بر روی محیطهای معمولی در دمای ۱۵ الی ۴۲ درجه سانتیگراد بخوبی رشد میکنند ولی در ۳۷ درجه سانتیگراد بهتر رشد میکنند. کلنیهای ۲۴ ساعتهی آنها در ژلوز ساده و دمای ۳۷ درجه سانتیگراد محدب، صاف، شفاف و بیرنگ و به قطر ۲ تا ۳ میلی متر می باشد.
آبگوشت را بطور یکنواخت کدر می کند و رسوب مختصر در ته لوله ایجاد می کند که با تکان دادن حل می شود. در محیط های افتراقی مانند اندو، مک کانکی، و دزوکسی کولات بعلت عدم تخمیر لاکتوز مانند سالمونلاها و برخلاف کلی فرم ها کلنی های بیرنگ ایجاد می کند. شیگلا نسبت به سالمونلا و سایر باسیل های انتریک مقاومت کمتری نسبت به عوامل فیزیکی و شیمیائی دارد. شیگلا دیسانتری از بقیه حساس تر است.
حرارت ۵۵ درجه سانتیگراد در مدت یکساعت و فنل ۱% در مدت نیم ساعت آنها را می کشد. نسبت به نور و خشکی حساس هستند ولی حرارت کم و محیط مرطوب برای آنها مناسب است و قادر هستند ۶ ماه در آب با دمای معمولی زنده بمانند.
باسیل های مولد دیسانتری که خشک شده باشند در روی ملحفه مدت ۶ هفته در تاریکی و دمای معمولی زنده می مانند. در خاک بیش از ۱۰ روز زنده نمی مانند. در مدفوع اگر دارای واکنش قلیائی باشد چند روز زنده می ماند ولی اگر واکنش مدفوع اسیدی باشد فوری از بین می روند. شیگلا بوسیلهی پاستوریزاسیون شیر و کلریزاسیون آب از بین میرود.
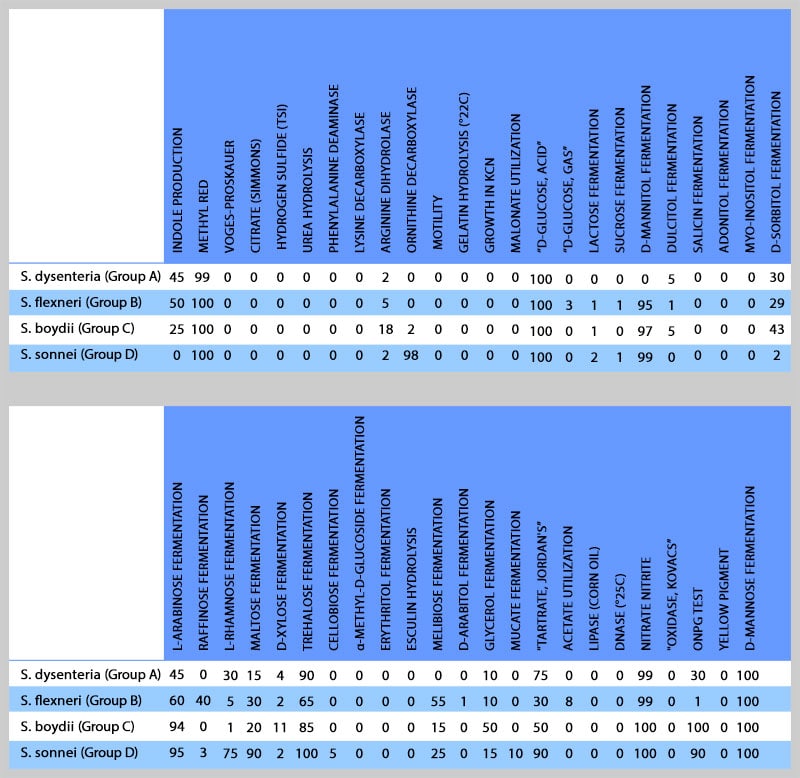
چهار گونه (گروه) در جنس شیگلا تشخیص داده شده است: شیگلا دیسانتریه[۱] (گروه A)، شیگلا فلكسنری[۲] (گروه B)، شیگلا بوئیدی[۳] (گروه C) و شیگلا سونئی[۴] (گروه D). در طبقهبندی CDC، سه گونه اول شیگلا چون از نظر بیوشیمیایی شبیه میباشند، مجموعهی شیگلا سروگروپ ABC نامیده میشوند. شیگلا سونئی كه عامل بیشترین عفونتهای شیگلا در ایالات متحده امریكا و کمترین در کشور ماست، بهراحتی از سه گروه اول تشخیص داده میشود زیرا برخلاف آنها دارای فعالیت دكربوكسیلاسیون لیزین و بتاگالاكتوزیداز است. شیگلا دیسانتریه كه عامل وخیمترین حالت بیماری است و اغلب از کشورهای در حال توسعه مانند کشور ما جدا می شود از دیگر گروهها بهواسطه عدم توانایی تخمیر مانیتول و توانایی تولید نوروتوكسین شیگا قابل افتراق است (جدول ۱). همچنین گونههای شیگلا را میتوان توسط اختصاصیت آنتیژنیكی O از یكدیگر افتراق داد.
نمونههای مدفوع، خون، CSF، مایع مفصلی، ضایعات کبدی، غدد لنفاوی، ضایعات واژن و غیره برای شناسایی شیگلاها استفاده میشود. برای تشخیص عامل اسهال خونی میتوان نمونههای مدفوع را كشت داد. البته بهترین نمونه برای كشت، سواب ركتال از زخمی است كه در طی سیگموئیدوسكوپی بدست میآید. دیسانتری حاصل از شیگلا را باید از بیماریهای شبه دیسانتری حاصل از اشریشیا کلی انترواینوازیو، كمپیلوباكتر ژوژنی و انگلهای انتامبا هیستولیتیكا و بالانتیدیوم كلی تشخیص داد. سیگموئیدوسكوپی نشان میدهد كه مخاط پرخون و هموراژیك است و حضور زخمهایی كه با غشاء كاذب فیبرینی پوشیده شدهاند را آشكار میسازد. مشاهده مخاط، PMN و خون در مدفوع از مشخصههای دیسانتری است و نشان میدهد كه دیواره روده مورد تهاجم قرار گرفته است. بعد از کشت نمونهها با بررسی تستهای بیوشیمیایی، جنس و گونههای شیگلا را تأئید قطعی میکنیم. در جدول زیر واکنشهای بیوشیمیایی گونههای مختلف جنس شیگلا جهت بررسی نهایی آنها نشان داده شده است.
جدول ۱: وجوه تمایز گونهها در جنس شیگلا

خواص بیوشیمیک شیگلا
به استثنای شیگلا سونه ای بقیه لاکتوز را تخمیر نمیکنند. بنابراین روی محیطهای محتوی لاکتوز و دارای معرف رنگ کلنی آنها بیرنگ است. گلوکوز را تخمیر کرده ولی گاز تولید نمیکنند ولی انواع نیوکاسل و منچستر گاز بوجود می آورند. به استثنای شیگلا دیسانتریه بقیه مانیتول را تخمیر میکنند. برعکس اشریشیا کولی لایزین دکربوکسیلاز منفی و از استات بعنوان منبع کربن استفاده میکنند. در محیط سیمون سیترات رشد نمی کنند، اوره آز، سولفید هیدروژن، KCN، و اکسیداز منفی بوده و کاتالاز مثبت هستند.
جدول ۲: واکنشهای بیوشیمیایی گونههای مختلف جنس شیگلا
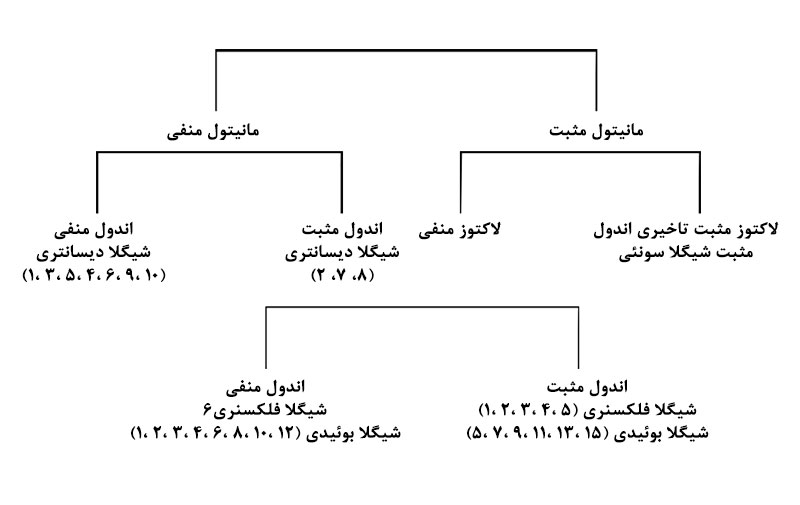
در ضمن با کمک فلوچارت زیر میتوان با توجه بهخصوصیات بیوشیمیایی نظیر مانیتول، لاکتوز و اندول بهآسانی انواع شیگلاها را مورد شناسایی قرار داد.
ایجاد اسید از گلوکز
البته جهت سهولت در کار پس از شناسایی جنس شیگلا میتوان از روشهای سرولوژیک آگلوتیناسیون بهوسیله آنتیسرم اختصاصی شیگلا دیسانتری کمک گرفت و بهسهولت گونه شیگلا دیسانتری را شناسایی و تأیید نمود. ضمناً از آنجایی که در بعضی از انواع شیگلا مشابه با سالمونلاها آنتیژن K وجود دارد، در هنگام آگلوتیناسیون صفحهای با آنتی سرم O چنانچه آگلوتیناسیون بوجود نیاید، توصیه میشود که شیرابهای از باکتری را در محلول سرم فیزیولوژی بمدت ۳۰ تا ۶۰ دقیقه در حرارت ۱۰۰ درجه سانتیگراد جوشانده و مجدداً با همان آنتی سرم آزمایش تکرار گردد.
تشخیص آزمایشگاهی
الف- آزمایش مستقیم میکروسکپی نمونه ی مدفوع: در آزمایش مستقیم باسیل های مولد دیسانتری را نمی توان از باکتری های دیگر تشخیص داد ولی ۲ مسئله را می توان روشن کرد: ۱- سیتولوژی مدفوع و ۲- وجود یا عدم آمیب دیسانتری و انگلهای دیگر.
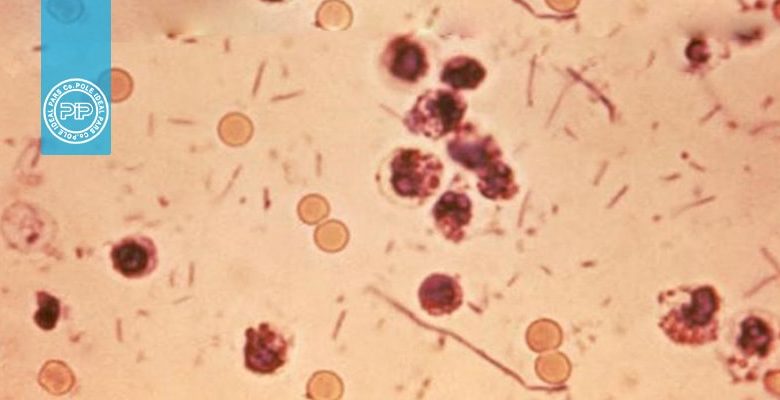
در اسهال خونی باسیلی حدود ۹۰% سلول های موجود در مدفوع را لکوسیت های چند هسته ای تشکیل می دهند در حالیکه در دیسانتری آمیبی و سالمونلائی سلول های چند هسته ای کمتر دیده می شود و منوسیت ها اکثریت سلولی را تشکیل می دهند. نیافتن آمیب و انگل های دیگر نیز اسهال خونی باسیلی را محتمل می سازد.
ب- کشت مدفوع: در ابتدای بیماری تقریبا همیشه می توان باکتری های مولد اسهال خونی را از کشت مدفوع بدست آورد. کشت مدفوع باید بلافاصله صورت گیرد زیرا کلی فرم ها و اسیدیتهی مدفوع آنها را از بین خواهند برد. اگر کشت فوری میسر نباشد مدفوع را باید در بافر گلیسرولدار (محیط ترانسپورت) قرار داد. برای کشت از محیط های دزکسی کولات سیترات، مک کانکی، EMB استفاده می شود.
تشخیص سم شیگا
با توجه به اینکه شناسایی ایزولههای تولیدکننده شیگاتوکسین و خود سم در نمونههای بالینی بسیار مهم است، در ادامه به روشهای شناسایی آن اشاره میگردد.
بهطور کلی تشخیص سم شیگا بر سه محور استوار است:
الف- شناسایی سم شیگاتوکسین Stx
ب- جداسازی و شناسایی ژن تولیدکننده شیگاتوکسین
ج- جداسازی و شناسایی باکتریهای تولیدکننده شیگاتوکسین
الف– شناسایی سم شیگاتوکسین (Stx)
برای این منظور معمولاً از روشهای زیر استفاده میگردد که در ذیل به آنها اشاره میگردد.
۱- سنجش سیتوتوکسیسیته سم با استفاده از کشت سلول (Tissue culture cytotoxicity Assay):
در این روش توکسین Stx بر روی محیط کشت سلولی اثر داده میشود و با مشاهده اثرات سیتوپاتیک میتوان سم را شناسایی نمود. لازم به ذکر است که بهتر است جهت کشت سلولی از سلولهای کلیه میمون سبز آفریقای یا ورو (vero) بهجای سلولهای هلا (Hela) استفاده شود. به این دلیل که سلولهای ورو واجد گیرندههای سطحی Gb3 و Gb4 بوده و بهوسیله آنها قادر به شناسایی stx2e که فقط به Gb4 متصل میشود، هستیم ولی سلولهای هلا بدلیل فقدان گیرنده Gb4 در این زمینه از حساسیت کمتری برخوردار هستند.
بدیهی است که این روش دارای حساسیت بسیار بالایی است، ولی بدلیل استفاده از محیط کشت سلولی و روشهای مبتنی بر آن در آزمایشگاههای معمولی استفاده از این روش قابل دسترس نیست و از طرفی نیاز به محیطی بسیار ایزوله و استریل و همچنین دقت بالایی دارد.
۲- روش الیزا
در این روش که از کیت الیزا و روشهای مبتنی بر کمپلکس آنتیژن-آنتیبادی استفاده میگردد، آنتیژن یا stx به آنتیبادی اختصاصی خود متصل شده و با ایجاد کمپلکس رنگی توسط دستگاه فوتومتر مخصوص که همان دستگاه الیزا ریدر است قابل شناسایی و تیتر کردن است.
بدیهی است که این روش از نظر حساسیت از روش کشت سلولی پایینتر است، اما از نظر اختصاصیت اتصال به آنتیبادی منوکلونال و از طرفی در دسترس بودن، قابلیت تیتراسیون و عدم نیاز به محیط کاملاً استریل و ایزوله نسبت به روش کشت سلولی ارجحیت دارد.
۳- روش رسوبی و ایمونودیفیوژن:
کمپلکسهای اختصاصی آنتیژن-آنتیبادی و واکنش متقاطع بهواسطه روشهای رسوبی در ژل شناسایی میشوند. در این روش آنتیبادی در غلظتهای معین همراه و مخلوط با ژل ساخته میشود. با حفر چاهکهای متعدد و تزریق موارد مشکوک به سم شیگا در هر چاهک و انکوبه کردن بمدت چند ساعت میتوان خط رسوبی سم شیگا و آنتیبادی اختصاصی آن را در اطراف چاهکهایی که از نظر وجود سم مثبت بودهاند مشاهده نمود. این روش درواقع یک متد مشابه به الیزا بوده ولی با مکانیسم سادهتر انجام میگیرد. برای اندازهگیری میزان کمّی (quantitative) سم میتوان از غلظتهای استاندارد توکسین بهصورت سریالی استفاده نمود و پس از رسم منحنی استاندارد، غلظت سم مجهول را مشخص نمود.
ب- جداسازی و شناسایی ژن تولیدکننده شیگاتوکسین
دومین راه شناسایی سم شیگا استفاده از روشهای مولکولی و تشخیص ژن کدکننده توکسین در باکتری است. همانطور که در گذشته نیز اشاره گردید، ژنهای کدکننده شیگاتوکسین در شیگلا دیسانتری روی کروموزوم قرار دارند، درحالیکه در باکتری EHEC ژنهای کدکننده توکسین روی ژنوم باکتریوفاژ مستقر هستند، بدین منظور میتوان از روشهای متعددی استفاده نمود که در ادامه به برخی از آنها اشاره میگردد.
۱- نشانگرهای (پروبهای) ژنتیکی:
نشانگرهای DNA همانند آنتیبادیها ابزار حساس و اختصاصی برای ردیابی و تعیین توالی اسید نوکلئوئیک کدکننده توکسین شیگا در نمونههای بالینی هستند. بهواسطه حساسیت و ویژگی روش DNA پروب میتوان گونههای تولیدکننده سم و ژنهای کدکننده توکسین را ردیابی نمود.
DNA پروب به شیوه شیمیایی سنتز شده یا بهواسطه کلون نمودن قطعات ژنومی توکسین شیگا در داخل ناقلین باکتریایی یا هر وکتور مناسب دیگر تهیه میگردند، سپس این پروبها با یک ماده رادیواکتیو نظیر P32 یا S35 یا مواد فلورسانس نشاندار میگردند. پس از ذوب نمودن (جدا نمودن رشتهها توسط حرارت)، DNA نمونه توسط مواد شیمیایی یا پروب به آن اضافه شده و اجازه هیبرید شدن داده میشود، توالیهای یکسان یا بسیار یکسان با یکدیگر هیبرید شده و بدین ترتیب میتوان ژنهای تولیدکننده و کدکننده شیگاتوکسین را ردیابی نمود و کمیت آنها را تعیین کرد. اندازهگیری و یا مشاهده میزان ساطع شدن مواد رادیواکتیو یا فلورسانس با میکروسکوپ ایمنوفلورسانس غیرمستقیم و یا با متد EIA میسر میگردد.
۲- استفاده از روشهای مختلف PCR
با استفاده از واکنش زنجیره پلیمراز (PCR) یک کپی از DNA ژن کدکننده توکسین شیگا را میلیونها برابر تکثیر میکنیم و سپس توسط متد ژل الکتروفورز و رنگآمیزی توسط رنگهایی که با اسید نوکلئوئیک متصل میشوند قادر به شناسایی این ژنها میشویم. این روش یکی از جدیدترین روشهای تجزیه و تحلیل ژنتیکی محسوب میگردد.
۳- استفاده از روش PCR-ELISA
در سالهای اخیر روشهای مختلف PCR، روشهای بالقوهای برای بهبود سرعت و حساسیت تشخیص گونههای مختلف شیگلا در نمونههای مختلف شیگلا در نمونههای مختلف فراهم کردهاند. روش مرسوم برای شناسایی و بررسی محصولات PCR، استفاده از ژل الکتروفورز و رنگآمیزی با اتیدیوم بروماید (Ethidium bromide) و دورگهسازی (Hybridization) است که علاوهبر زمانبر بودن، از مواد سمی مانند اتیدیوم بروماید نیز در این روش استفاده میشود. روش PCR-ELISA یک جایگزین مناسب برای مواد یادشده فوق است و سرعت و حساسیت قابلقبولی را در تشخیص مقادیر اندک توالیهای اختصاصی ژنهای بیماریزا فراهم میآورد. در این روش از ماده دیگوکسیژنین (Digoxigenin) استفاده میشود. این ماده یک عصاره استروئیدی است که از گیاه puporea بدست میآید. دیگوکسیژنین روش تشخیص مناسب و غیر رادیواکتیوی را برای تشخیص محصولات PCR در قالب پلیتهای میکروتیتر (Micro titer Plates) ایجاد کرده است. در این روش آغازگر (Primer) به همراه دیگوکسیژنین در واکنش PCR بهکار میرود که منجر به ورود این ترکیبات به ساختار PCR میشود. محصولات تولیدشده در ظرفهای پوشیده از استرپتواویدین (Sterptoavidin) ریخته شده که بر اساس تمایل شدید اویدین (Avidin) و بیوتین (Biotin) به سطح ظرف میچسبند. در نهایت قطعه تکثیریافته حاوی دیگوکسیژنین با کمک آنتیبادی ضد دیگوکسیژنین کونژوگه (Conjugated) با آنزیم پراکسیداز (Proxidase) شناسایی میشود و درنهایت با الیزا ریدر نتایج خوانده میشود.
محاسن روش PCR-ELISA:
۱- همانطورکه در بالا اشاره شد محدودیتهای موجود و معایب روشهای دیگر از جمله PCR را ندارد.
۲- روش اختصاصی و سریع بوده و میتواند مدیریت کیفیت محصولات غذایی را در مقایسه با روشهای باکتریشناسی بهبود بخشد.
۳- از ویژگی دیگر این روش تشخیصی میتوان به امکان آنالیز همزمان تعداد زیاد نمونهها با استفاده از میکروپلیتهای ۹۶ خانهای اشاره کرد که بهخصوص در زمان شیوع همهگیری بسیار کاربرد دارد.
۴- استفاده از روش Real Time PCR:
بدیهی است میتوان جهت شناسایی دقیقتر و سریعتر و همچنین شناسایی ژن کدکننده توکسین بهصورت کمّی از روش PCR کمّی استفاده نمود. در این روش برخلاف روش PCR معمولی که یک روش End point است و پس از اتمام سیکلها اندازهگیری و شناسایی روی ژل الکتروفورز انجام میگیرد، تکثیر در هر لحظه از زمان صورت میگیرد. در ضمن در این روش نیازی به ژل نیز وجود ندارد.
در روش Real Time نیازمند ۱۰۰۰ برابر کمتر از ژن توکسین برای شناسایی هستیم، در نتیجه قدرت شناسایی فوقالعاده بالا میرود. این روش اختصاصیتر، حساستر و تکرار پذیرتر است.
این روش که نیاز به دانش بسیار بالایی دارد مبتنی بر استفاده از پروبهای مخصوصی است که در سمت ۵َ آن یک ماده فلورسانس رنگزا و در سمت ۳َ آن یک ماده خاموشگر قرار گرفته است. وقتی ماده گزارشگر (فلورسانس) و اطفاکننده (خاموشگر) در مجاورت هم قرار بگیرند، اثر یکدیگر را خنثی میکنند. پس از تکثیر رشتهها همانند همان روشی که در PCR معمولی صورت میگیرد، ماده گزارشگر آزاد شده و میزان تشعشع آن توسط یک دوربین فوقالعاده حساس و دقیق دریافت میگردد و در نهایت این اطلاعات به قسمت آنالیزکننده دستگاه که یک کامپیوتر است منتقل شده و نمودارهای تکثیر رسم و آنالیز میگردند، از این رو محصول در PCR معمولی در آخرین فاز یعنی فاز پلاتو صورت میگیرد، ولی در Real Time منحنی محصول در فاز رشد بررسی میگردد. میزان خطا بسیار کم شده و دقت افزایش مییابد.
ج– جداسازی و شناسایی باکتریهای تولیدکننده شیگاتوکسین
باکتریهای غیر از شیگلاها که تولیدکننده سم شیگا هستند تیپهای مختلفی از انتروهموراژیك اشریشیا کلی میباشند.
واژهنامه
| Sh. boydii | [۳] | Sh. flexeneri | [۲] | Sh. dysenteriae | [۱] |
| Sh. sonnei | [۴] |



یک نظر