واکنش زنجیره ای پلیمراز (PCR) – قسمت اول
مقدمه
امروزه روشهای بیولوژی مولکولی و مهندسی ژنتیک کاربرد وسیعی در علومزیستی یافته و به دلیل سرعت و دقت بالای آن، تا حدودی جایگزین برخی از روشهای متداول شدهاند. کاربرد وسیع این روشها در تعیین توالی ژنها، طبقهبندی ارگانیسمها و تشخیص عوامل بیماریزا در اپیدمیها در مناطق مختلف جهان، ایجاد تغییرات ژنتیکی در باکتریها، ویروسها، گیاهان و حتی جانوران در جهت افزایش کارایی و یا درمان بیماریها، همگی از اهمیت و نیاز به فراگیری و راهاندازی این روشها در آزمایشگاههای تحقیقاتی حکایت دارد. در سال 1983 ایده روشی جدید در ذهن کری مولیس[1] شکل گرفت و آن را در همان سال در شرکت Ceteus به ثبت رساند. اولین مطلب در مورد انجام واکنش زنجیره ای پلیمراز (PCR) در سال 1985 منتشر شد و در سال 1986 شرکت Cetus با شرکتی دیگر به نام Perkin Elmer همکاری جدیدی را آغاز کردند و با گذشت زمان این همکاری به شرکت رُش[2] رسید و در نهایت حق امتیاز روش PCR در اختیار شرکت رُش قرار گرفت. این روش از نظر اصول علمی تشابه زیادی به همانندسازی DNA دارد و در واقع برگرفته از آن است. روش PCR تحول مهمی را در بیولوژی مولکولی پدید آورده که با این روش میتوان قطعات DNA از سلولهای مختلف، زنجیره منفرد DNA یا مولکولهای RNA حتی DNA از یک سلول تنها را تکثیر نمود. اسیدهای نوکلئیک موجود در این منابع به عنوان الگو برای سنتز DNA عمل میکنند. این روش به ویژه در میکروبیولوژی تشخیصی، ویروسشناسی و پزشکی قانونی برای مشاهده و تکثیر قطعات مهم تشخیصی از مولکول DNA مفید است.
واکنش زنجیره ای پلیمراز
واکنش زنجیره ای پلیمراز[3]، روشی است که در آن با یک برنامهی دورهای تکرار شونده از گرم و سرد کردن DNA به همراه یک DNA پلیمراز مقاوم به حرارت و دو توالی ویژه DNA به عنوان آغازگر یا پرایمر[4] به منظور تکثیر انتخابی یک بخش کوچک اختصاصی از ژنوم استفاده میشود. فرایند تکثیر DNA با این روش به صورت تصاعدی هندسی است و بنابراین میتوان مقادیر زیاد DNA بدست آورد. به عنوان نمونه وقتی از PCR استفاده میشود که مقادیر بسیار جزئی از توالی ویژهای در اختیار است و به منظور مطالعهی این ژنها، DNA را باید به دفعات زیاد تکثیر کرد تا به مقدار کافی در دسترس قرار گیرد.
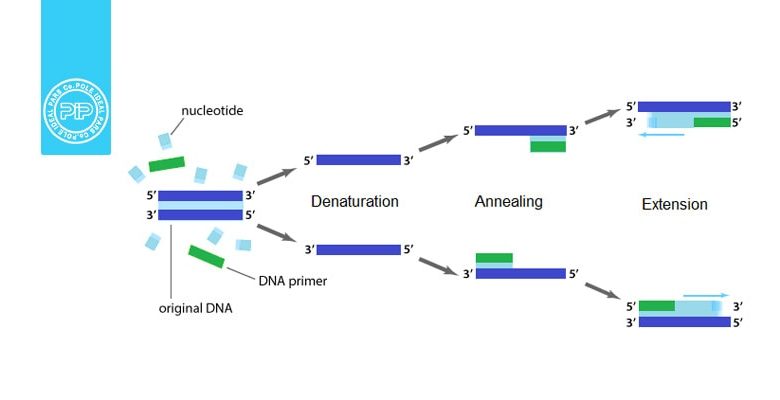
واکنش زنجیره ای پلیمراز از نظر اصول علمی تشابه زیادی به همانندسازی DNA دارد و در واقع برگرفته از آن است. یادآوری میشود که DNA پلیمراز، DNA تک رشتهای را از جهت ‘5 به ‘3 به عنوان الگو مورد استفاده قرار میدهد و رشته مکمل را در جهت ‘3 به ‘5 میسازد. همچنین DNA پلیمراز برای شروع احتیاج به یک پرایمر دارد. برای انجام PCR ،DNA پلیمراز، نوکلئوتیدتری فسفاتها و پرایمر لازم هستند. از آنجاییکه DNA دو رشته است، دو نوع پرایمر در واکنش زنجیره ای پلیمراز (PCR) مورد نیاز است. این دو پرایمر دو عمل انجام میدهند. اول اینکه محل ژنی که باید تکثیر شود را مشخص مینمایند و دوم اینکه اندازهی قطعات تکثیر شونده را تعیین میکنند. عمل اول کاملا مشخص است، در مورد عمل دوم باید گفت که وقتی این دو پرایمر به دو ناحیهی مختلف DNA و به سمت هم قرار میگیرند، DNA پلیمراز تنها قطعات را در بین این دو ناحیه همانندسازی میکند و به این ترتیب طول قطعات ساخته شده تعیین میشود. (شکل 1)
برای شروع PCR ،DNA الگو، پرایمرها و نوکلئوتید تریفسفاتها و DNA پلیمراز در یک لوله با هم مخلوط میشوند. سپس لوله را گرم میکنند تا دو رشته DNA از هم جدا شوند. سپس لوله را سرد کرده تا پرایمرها به نواحی مورد نظر متصل شوند و DNA پلیمراز شروع به همانندسازی از روی DNA الگو بنماید. بعد از مدت زمان لازم برای همانندسازی بار دیگر پرایمرها به نواحی مکمل خود متصل میشوند. چون در مرحلهی قبل رشته DNA در ناحیه مورد نظر مضاعف شده است، در این مرحله چهار رشتهی الگو برای همانندسازی وجود دارد و در نتیجه در پایان این مرحله به وجود میآید. در مرحلهی بعد 16 نسخه و به همین صورت به طور تصاعدی تعداد نسخههای ژنها زیاد میشود.
در ابتدای طراحی PCR از آنزیم DNA پلیمراز E.coli استفاده شد ولی این آنزیم به حرارت حساس بوده و بنابراین پس از هر بار حرارت دادن محیط واکنش تا دمای 94 درجهی سانتریگراد، افزودن دوبارهی آنزیم تازه به محیط لازم بود. یکی از مهمترین کشفیات در این زمینه این بود که باکتریهای موجود در چشمههای آب گرم دارای DNA پلیمرازهایی هستند که نسبت به حرارت مقاوم بوده و حتی در دمای بالا فعالیت بهتری دارند. برای مثال باکتری Thermus aquaticus دارای DNA پلیمرازی است که در دمای 94 درجهی سانتیگراد کاملا پایدار است و همچنین دمای مطلوب (اپتیمم) عمل آن نیز 72 درجهی سانتیگراد میباشد. این DNA پلیمراز که به طور خلاصه Taq پلیمراز نامیده میشود، باعث شد که به راحتی PCR به صورت اتوماتیک انجام شود و با افزودن یکبار آنزیم Taq پلیمراز دیگر نیازی به اضافهکردن مجدد آن نباشد. مزیت بسیار مهم دیگر Taq پلیمراز افزایش دادن حساسیت و دقت PCR است. در دمای پایین (30 درجه سانتیگراد) که برای DNA پلیمراز E.coli به کار میرفت، پرایمرها ممکن است به جایگاههایی که توالی تا حدودی مشابه دارند نیز متصل شوند، زیرا در دمای پایین تعداد کمتری پیوند هیدروژنی برای اتصال پرایمرها نیاز است، بنابراین پرایمرها با اتصال به نواحی نسبتا مشابه، باعث ایجاد اشتباه در انجام مراحل PCR میشوند. ولی وقتی که واکنش در دمای 72 درجه سانتیگراد (دمای اپتیمم فعالیت Taq پلیمراز) انجام شود، اتصال پرایمرها به نواحی غیر از ناحیهی اصلی کاهش مییابد. به این صورت پس از پایان PCR رشتههای DNA کاملا مشابه و خالص به دست خواهد آمد.
کاربرد واکنش زنجیره ای پلیمراز
به طور کلی واکنش زنجیره ای پلیمراز (PCR) به دو منظور اصلی به کار میرود:
- تهیه نسخههای متعدد از یک ژن
- بررسی حضور یا عدم حضور یک ژن خاص در یک قطعهی DNA
کاربرد دوم از اهمیت بیشتر برخوردار است. از جمله آن میتوان به تشخیص بیماریهای ژنتیکی در قبل از تولد، تعیین جنسیت، بررسی عفونتهای باکتریایی و ویروسی که در قدیم از روش وقتگیر کشت استفاده میشد، اشاره کرد. استفاده از تکنیکهای کشت آزمایشگاهی برای شناسایی پاتوژنهای میکروبی (ویروسی، باکتریایی، انگلی) با دو مشکل روبرو است:
- میکروارگانیسمهایی که نمیتوان در آزمایشگاه آنها را تکثیر داد تا به راحتی مشاهده شوند، باکتری در این حالت زنده است و توانایی ایجاد بیماری را دارد اما قادر نیستند در محیطهای آزمایشگاهی رشد کنند.
- زمان لازم برای گرفتن جواب مثبت یا منفی طولانی است و روزها تا هفتهها به طول میانجامد.
اما تکنیکهای جدید برای تشخیص سریع، حساس و اختصاصی پاتوژنها طرحریزی شده که یکی از آنها استفاده از پروبهای ژنتیکی و یا بهکاربردن واکنش زنجیره ای پلیمراز است که میتواند حتی یک ویروس یا یک باکتری را بر حسب نوع آن تشخیص دهد.
نمونههای مورد استفاده برای واکنش زنجیره ای پلیمراز
طیف وسیعی از مواد بیولوژیک، لکههای خون، سرم، بزاق، منی، مو، مایع نخاعی، استخوان، مایع آمنیون، سلولهای جنینی در مرحله بلاستولا، نمونههای بیوپسی و یا آتوپسی میباشند که هرچه آلودگی در نمونه کمتر باشد، حساسیت و دقت نتایج بیشتر خواهد بود.
اصول و روشهای واکنش زنجیره ای پلیمراز
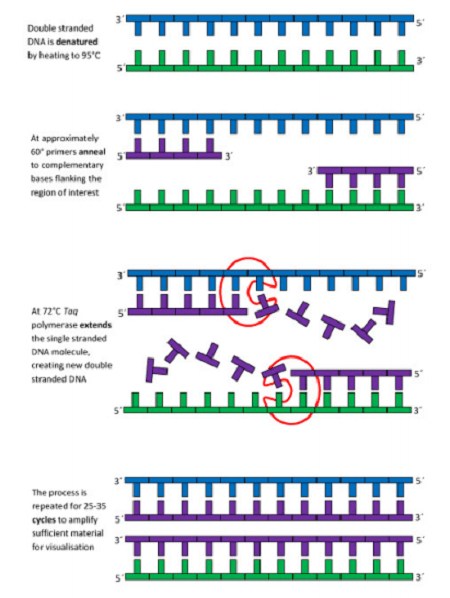
روش PCR بر مبنای سه روش ساده بنا شده که انجام این سه مرحله در هر واکنش سنتز DNA ضرورت دارد که با برنامه دادن به دستگاه Thermo-cycler اجرا میشود. این مراحل عبارتنداز:
مرحله Denaturation/ دناتوراسیوم
طی این مرحله DNA دو رشتهای به واسطه اعمال حرارتی در حدود 95-90 درجه سانتیگراد از هم جدا میشوند. (شکل 2)
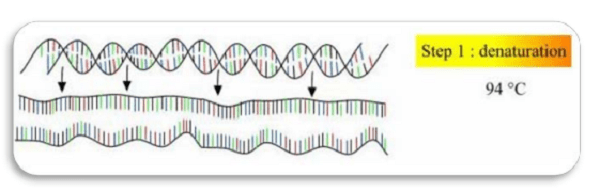
مرحله Annealing/ اتصال
در این مرحله با کاهش حرارت سیستم، دما به 53 الی 75 درجه سانتیگراد رسیده تا پرایمرها در محل مناسب روی رشته مکمل متصل شوند. در این مرحله باید دقت لازم به عمل آید و دما باید به درستی انتخاب شود. این کار به طور مستقیم و اتوماتیک توسط کامپیوتر و یا توسط متخصص به طور دستی و با توجه به دانش فنی و تجربه صورت میگیرد. اگر دما در این مرحله به درستی انتخاب نشود، احتمال تکثیر غیراختصاصی DNA وجود دارد به طوری که در دمای پایینتر از حد استاندارد، تکثیر غیراختصاصی و در دمای بالاتر از معمول عدم تکثیر DNA رخ میدهد. (شکل 3)
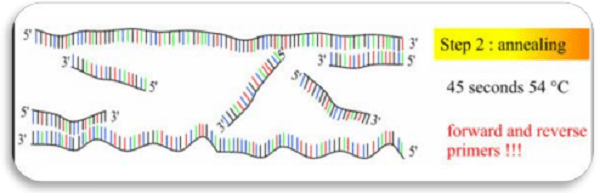
مرحله Extension/ گسترش
در این مرحله که دمای آن میبایست برای آنزیم DNA پلیمراز مطلوب باشد، موجب توسعه پرایمرها شده و همانندسازی DNA هدف صورت میگیرد. در دمای حدود 72 درجه سانتیگراد آنزیم مقاوم به حرارت[5] چهار نوع نکلئوتید dATP، dGTP، dTTP، dCTP موجود در محیط و بافرهای PCR شامل Tris و پرایمرهای جفت شده به DNA را در حضور Mgel2 مورد استفاده قرار میدهد و واکنش پلیمریزاسیون را کاتالیز مینماید و سبب طویلشدن رشته DNA جدیدی که توسط پرایمر ساخته شده، میشود. (شکل 4)
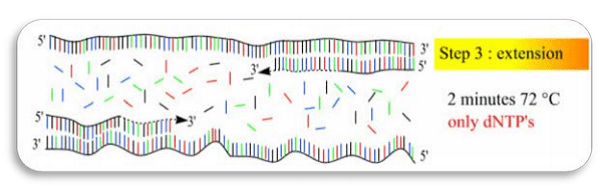
نتیجه چرخه سه مرحلهای فوق سنتز دو مولکول جدید DNA است، سنتز DNA جدید به صورت تصاعدی آنقدر ادامه مییابد تا اینکه یکی از مواد تشکیلدهنده محیط واکنش کاهش یابد و غیرفعال شود. به طور کلی حدود 25-35 سیکل کافی است تا از مقدار بسیار کم DNA صدها هزار نسخه DNA سنتز گردد. از نظر تئوری بعد از 20 سیکل 1 میلیون و بعد از 35 سیکل حدود 68 میلیارد کپی حاصل میگردد. نکتهای که در مراحل مختلف واکنش زنجیره ای پلیمراز (PCR) باید مورد توجه قرار گیرد، زمان لازم برای رسیدن از یک دما به دمای دیگر[6] است که زمان کوتاهی است. (شکل 5)
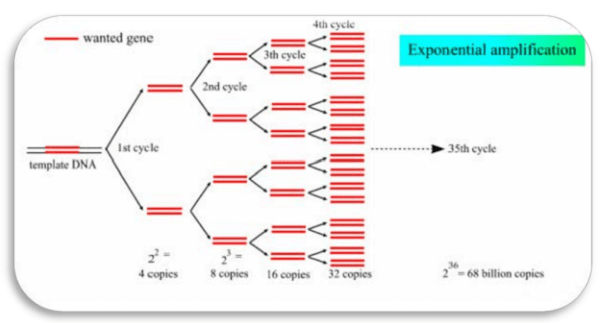
پارامترهای موثر در واکنش زنجیره ای پلیمراز
- زمان و دمای Denaturation بستگی به تعداد بازهای آلی C و G دارد.
- دمای Annealing پرایمرها که باید 3-4 درجه کمتر از دمای ذوب پرایمرها باشد.
- زمان Primer extension که به تعداد بازهای بین دو پرایمر بستگی دارد.
- تعداد سیکلها
- Ramp time: زمانی که طول میکشد تا دمای مبدا دستگاه به دمای مقصد برسد. هرچه این زمان کمتر باشد، نتیجه کار بهتر است و واکنش در زمان کمتری در دمای ناخواسته قرار میگیرد.
- غلظت dNTPها و یون منیزیوم مجموعهای را تشکیل میدهند که موجب فعالیت آنزیم پلیمراز میشوند و غلظت این دو ماده تابعی از یکدیگر هستند.
- غلظت Template DNA یک دهم تا یک میکروگرم میباشد. اگر DNA هدف در ژنوم به صورت نسخههای تکراری باشد، بهتر است.
- اضافهکردن تشدید کنندههای PCR
- حذف مهارکنندههای آنزیم از محیط
- بهتر است نقطه ذوب پرایمرها شبیه به هم باشد.
طراحی پرایمر
پرایمرهای PCR به صورت کاملا اختصاصی و مکمل ناحیه مورد نظر DNA هدف طراحی میگردند. پرایمرها میبایست واجد 20-30 باز باشند و پرایمرهایی با بیش از 30 باز اختصاصیت خوبی نخواهند داشت. همچنین پرایمرها باید دمای اتصال بالا داشته باشند. بهتر است تعداد بازهای دو پرایمر مساوی باشند و از پلی پورین یا پلی پیریمیدین نباشند. همچنین بهتر است نواحی تکرارشونده نیز نداشته باشند. اگر بازهای گوانین[7] یا سیتوزین[8] به صورت تکراری و پشت سرهم باشند، پرایمر به صورت لوپ در میآید و عملا سیستم کار نمیکند. نرم افزارهایی مانند “Oligo” طراحی پرایمر را انجام میدهند. بعد از طراحی پرایمر بهتر است توسط نرم افزارهایی مانند Blast آنها را چک نمود تا مشخص شود که به کدام ژنها میتوانند متصل گردند.
انواع واکنش زنجیره ای پلیمراز
مالتیپلکس پی سی آر (Multiplex-PCR)
یکی از روشهای تغییر یافته PCR است که در آن تنها یک جایگاه ژنی مورد بررسی قرار میگیرد. با استفاده از پرایمرهای مختلف میتوان چندین جایگاه را مورد بررسی قرار داد و از چندین جفت پرایمر اختصاصی جهت تکثیر استفاده میشود. کاربردهای این روش میتواند شامل موارد زیر باشد:
- بخشهای بزرگی از یک DNA (هدف)، جهت جستوجوی تغییرات میتوانند بررسی شود. برای مثال کشف نقصها در بیماری دیستروفی عضلانی دوشن یا کشف بخشهای مختلف IS6110 و IS986 در مایکوباکتریوم توبرکلوزیس عامل بیماری سل
- بخشهای غیرمربوط به هم در ژنوم هدف میتواند مورد آزمایش واقع شود
- میتوان از طریق این روش با پرایمرهای مختلف به جستوجوی عوامل مختلف پرداخت، مانند شناسایی عوامل شایع مننژیت
این روش بیشتر برای شناسایی جایگاههایی از ژنها به کار میرود که انواع زیادی از جهش در آنها به وقوع میپیوندد.
آرتی-پی سی آر (RT-PCR)
این روش به PCR نسخهبرداری معکوس نیز معروف است که ماده اولیه در آن RNA است. اولین مرحله در این روش تبدیل RNA به DNA) DNAای که مکمل توالیهای mRNA است) توسط آنزیم نسخه بردار معکوس صورت میگیرد (RT). برخی از موجودات مانند برخی از ویروسهای RNA دار، ژنومشان تنها از RNA ساخته شده است. بعضی از ویروسها مانند ویروس هپاتیت B هرگز به شکل DNA مابین در اثر آنزیم نسخهبردار معکوس درنمیآید. آنزیم نسخهبردار معکوس (RT) در این روش از “AMV) Avian Myeloblastosis Virus)” و “(Moloney Murine Leu Kemia Virus (MMLV” به دست آمده است.
کاربرد این آنزیم به دلیل آن که آنزیم به حرارت حساس بود در ابتدا پایین بود ولی با کشف باکتری به نام “ترموس ترموفیلوس” یک DNA پلیمراز مقاوم به نام (Tth) بهبود یافت که در حضور یون Mn+2 دارای فعالیت نسخهبرداری معکوس است و در دمای 72 درجه سانتیگراد توسط این آنزیم از روی RNA ،DNA ساخته میشود و سپس Mn+2 اضافی توسط اتیلن گلیکول تترااستیک اسید (EGTA) حذف میشود و سپس این آنزیم از DNAای که خود ساخته استفاده و آن را تکثیر میکند.
آرمز پی سی آر (ARMS-PCR)
این روش تکثیری قدرتمند برای مشخصکردن جهشهای نقطهای است. در این روش از پرایمرهای جهشیافته و طبیعی در دو لوله جداگانه استفاده میشود. اگر عمل پلیمریزاسیون در لوله حاوی پرایمر طبیعی انجام شود، نشاندهنده نبود جهش نقطهای در باز مورد نظر است و اگر عمل پلیمریزاسیون در لوله حاوی پرایمر جهش یافته انجام شود، نشاندهنده حضور جهش نقطهای در باز مورد نظر است. این روش نامهای دیگری نیز دارد مانند: MAMA-PCR مخفف Mismatch Amplification Multation Assay و COP-PCR مخفف Competitive Oligonucleotide Primming.
نستد پی سی آر (Nested-PCR)
در این روش از دو جفت پرایمر استفاده میشود، طوری که جفت دوم در بین جفت اول جای میگیرد. در این روش ابتدا پرایمر بیرونی توالی هدف در طول 15 الی 30 چرخه تکثیر میشود، سپس محصول واکنش زنجیره ای پلیمراز (PCR) حاصل به لولهای دیگر منتقل میشود و به عنوان الگو و با استفاده از جفت پرایمر داخلی مرحله دوم PCR انجام شده و ترادف کوچکتری از DNA که درون PCR اولی است، به اندازه 15 الی 40 چرخه تکثیر میشود. مزایای این روش تغییریافته PCR عبارت است از:
- نیاز به پروب (کاوشگر) و تاییدهای بعدی کمتر است
- حساسیت در این روش به میزان زیادی بالاتر است
- به دلیل انتقال محصول PCR دور اول به لوله جدید، ممانعتکنندهها رقیق میشوند. این روش در تعیین جنسیت جنین در سه ماهه اول بارداری استفاده شده و از این طریق توانستهاند بیماریهای وابسته به جنس را تعیین کرده و از تولد کودکان بیمار جلوگیری کنند.
همچنین ویروس “سیتومگالووویروس” که میتوانند سبب ناشنوایی در 1 درصد کودکان شود، توسط این روش تشخیص داده شده و امکان درمان زودهنگام از این طریق امکانپذیر است. جنینهای مبتلا به سندروم داون نیز در مرحله بارداری مادر با این روش تشخیص داده میشوند.
Real-Time PCR
به علت ورود نسل جدیدی از ترموسایکلرها با سیستم فلورومتری که اجازه پایش پیوسته خاصیت فلوئورسانس محصول PCR در زمان جمعشدن را میدهد، این روش ابداع شد. در این روش از کاوشگرها یا پروبهای هیبریداسیون نشاندار شده با رنگهای فلورسانس در انتهای 5 یا 3 استفاده میشود که امکان پایش پیوسته محصول PCR را بدون جداسازی آنها در روشهای الکتروفورز در ژل آگاروز پلیآکریلآمید میدهد. این سیستم در سال 1992 کشف شد. این روش به دلیل کاهش زمان سیکلهای PCR، حذف مرحله Post-PCR و کاربرد نشانگرهای فلوروژنیک و روشهای حساس آشکارسازی تابشی آنها باعث افزایش سرعت این سیستم نسبت به سیستم PCR معمولی شده است. سازندگان و کاربران این روش سعی میکنند محصول PCR کوچکتر طراحی کنند تا سرعت افزایش یابد اما تجربه نشان داده که کاهش اندازه محصول لزوما بازده واکنش زنجیره ای پلیمراز (PCR) را بهینه نمیکند. البته این روش دارای معایبی نیز است که از جمله میتوان به عدم توانایی در مشخصکردن اندازه محصول بدون بازکردن سیستم و ناسازگار بودن برخی پلتفرمها با شیمی برخی رنگهای فلورژنیک اشاره کرد. برای شناسایی بسیاری از ویروسهای عامل بیماریهای انسان از این روش استفاده شده است.
واژهنامه:
| (Polymerase Chain Reaction (PCR | [3] | Hoffiman La Roche, Roche Molecular System | [2] | Kary Mullis | [1] |
| Ramping Time | [6] | Taq polymerase | [5] | Primer | [4] |
| (Cytosine (C | [8] | (Guanine (G | [7] |