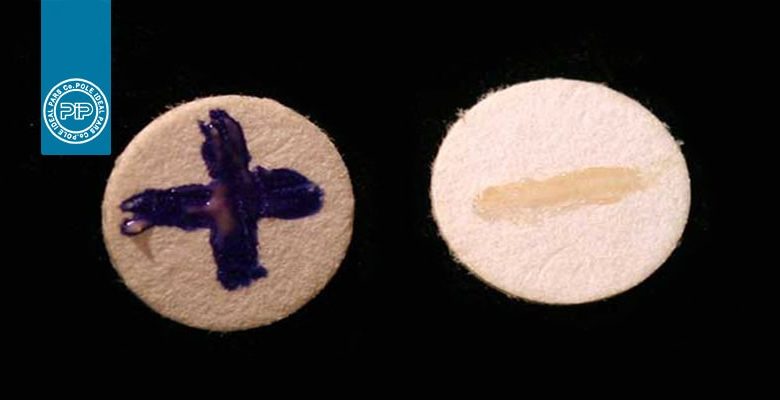
تست اکسیداز
تهیه و تنظیم: دکتر محمد قهری
مقدمه
واکنش اکسیداز برای شناسائی باکتریهای گرم منفی آزمایش بسیار سودمندی است. از آنجا که این واکنش تحت تاثیر PH محیط کشت ، سن کلنی، نوع و ترکیب معرف مورد استفاده و (طول) زمان انجام واکنش قرار میگیرد لازم است که روش انجام آزمایش در آزمایشگاهها استاندارد شود. روشی که در ابتدا توسط کواکس ( Kovacs ) در سال ۱۹۵۶ توصیف شده عموما توصیه گردیده است اگر چه برخی از گونه های باسیل های گرم منفی واکنشهای ضعیف و یا متغیری با این معرف میدهند. ثابت شده است که برخی از معرف های اکسیداز تجارتی که بر اساس روش کواکس تهیه میشوند برای جنس پاستورلا نامناسب هستند. نتایج متغیری در واکنش اکسیداز با برخی از استرینهای Aeromonas hydrophila و Aeromonas punctata یافت شده که به علت PH کمتر از ۵/۲ در محیط کشت بوده است.
۱- اصل و مبنای انجام تست اکسیداز :
برای تعیین وجود آنزیم های اکسیداز در باکتریها بکار میرود.
۲- مقصود و منظور از انجام تست اکسیداز :
الف- تست اکسیداز در اصل و از ابتدا برای شناسائی نایسریاها ابداع شد و بعدا برای تشخیص سودوموناسه از سایر اعضاء اکسیداز منفی انتروباکتریاسه ها نیز بکار گرفته شد.
ب- اکثر باکتریهای گرم مثبت اکسیداز منفی میباشند.
ج- در بین آنتروباکتریاسه ها فقط پلزیوموناس شیگلوئیدس (Plesiomonas Shigelloides) اکسیداز مثبت میباشد.
د- برای کمک به تشخیص افتراقی بین جنسهای مختلف بکار میرود:
- موراکسلا (+) و نایسریا (+) از اسینتوباکتر (-)
- آئروموناس (+)، پلزیوموناس شیگلوئیدس (+) و ویبریو (متغیر، معمولا +) از سایر اعضاء انتروباکتریاسه (-)
ه – بعنوان کمک برای تشخیص افتراقی بین گونهها در باکتریهای غیر رودهای گرم منفی :
- باکتروئیدس دیستازونیس Bacteroides distasonis (+)، باکتروئیدس اگرتی ئی B.eggerthii (+) و باکتریوئیدس یورئولایتیکوس B.ureolyticus (+) از سایر گونههای باکتروئیدس (-) که غالبا از نمونههای کلینیکی جدا میشوند.
- بارتونلافلیس Bartonella felis (+)، بارتو نلا کین تانا B.quintanaء(w+) و بارتونلاوینسونی ئی B.vinsoniiء(w+) از بارتوتلا باسیلیفرمیس B.bacilliformis (-)، بارتونلا الیزابتا B.elizabethae (-)، وبارتونلاهنسلا B.henselae (-)، (بارتونلا کین تانا و بارتونلا وینسونی ئی با معرف کواکس اصلاح شده واکنش مثبت ضعیف میدهند ولی با روشهای معمولی نتیجه منفی میدهند.)
- بوردتلا پارا پرتوزیس (+) از سایر گونههای بوردتلا (-).
- گونههایی که بطور شایعتری جدا میشوند: بورخولدریا گلادیولی Burkholderia gladioli (-) و بورخولدریامالئی B.mallei (متغیر) از بورخولدریا سپاسیا B.cepacia (+) و بورخولدریا سودومالئی B.pseudomallei (+).
- گونههایی که غالبا جدا میشوند: کاپنوسایتوفاگا کانیمورسوس Capnocytophaga canimorsusء(w+) و کاپنوسایتو فاگا ساینو دگمی C.cynodegmi (+) از کاپنوسایتوفاگاژنژیوالیس C.gingivalis (-)، کاپنوسایتوفاگا اوکراسه آ C.ochracea (-) و کاپنوسایتوفاگااسپوتیگنا C.sputigena (-).
- هموفیلوس آفروفیلوس Haemophilus aphrophilus (-)، هموفیلوس پاراگالیناروم H.paragallinarum (-)، هموفیلوس پاراسوئیس H.parasuis (-) هموفیلوس سگنیس H.segnis (-) از سایر گونههای هموفیلوس که مثبت میباشند.
- سودو موناس سیرینگا P.syringae (-)، سودو موناس ویریدی فلاوا P.viridiflava (-) از سایر گونههای سودوموناس که دارای واکنش مثبت میباشند.
- ویبریو گازوجنز Vibrio gazogenes (-) و ویبریو مچنیکوفی ئی V.metschnikovii (-) از سایر گونههای ویبریو که دارای واکنش مثبت هستند.
و- جهت کمک به تشخیص باکتریهای غیر رودهای گرم منفی:
Acidovorax spp (+)
Actinobacillus SPP (معمولا +، متغییر)
Aeromonas SPP (+)
Afipia SPP (+)
Agrobacterium SPP (معمولا +، متغییر)
Alcaligenes SPP (+)
Brevundimonas SPP (+)
Brucella SPP (+)
Campylobacter SPP (+)
Cardiobacterium hominis (+)
Chromobacterium violaceum متغیر، معمولا با معرف کواکس واکنش + میدهد. رنگدانه بنفش مربوط به باکتری ممکن است با قرائت نتیجه تست مداخله کند. استرینهای اکسیداز منفی ممکن است با گونههای رودهای باعث اشتباه شوند و استرینهای اکسیداز + ممکن است با گونههای آئروموناس ویبریو اشتباه شوند.
Comamonas SPP (+)
Eikenella corrodens (+)
Flavobacterium SPP (+)
Helicobacter SPP (+)
janthinobacterium lividum (+) متغیر، معمولا با معرف کواکس واکنش + میدهد. رنگدانه بنفش ممکن است در تفسیر آزمایش مداخله نماید.
Kingella SPP (+)
K.denitrificans و K.kingae با معرف دی متیل واکنش ضعیفی ( + ضعیف) میدهند و با معرف تترامتیل پارافنیل آلانین واکنش + میدهند.
Methylobacterium SPP (+)
Moraxella SPP (+)
Morococcus cerebrosus (+)
Neisseria SPP (+) آزمایش اکسیداز آزمایش کلیدی برای تشخیص گونه های نایسریا است.
Ochrobactrum SPP (+)
Oligella SPP (+)
Pasteurella SPP (+)
Psychrobacter SPP (+)
Ralstonia SPP
Roseomonas SPP (+)
Shewanella SPP (+)
Sphingomonas (متغییر)
Suttonella indologenes (+)
Taylorella equigenitalis (+)
Weeksiella SPP (+)
Wolinella succinogenes (+)
Xanthobacter SPP (+)
۳- اصول بیوشیمی تست اکسیداز :
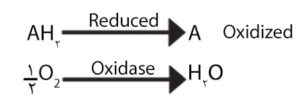
تست اکسیداز بر اساس تولید آنزیم اکسیداز داخل سلولی ( باکتریائی) انجام میگیرد. واکنش اکسیداز مربوط به سیستم سیتو کروم اکسیداز است که اکسیداسیون “سایتوکروم احیا شده” را بوسیله اکسیژن ملکولی فعال میکند. (بعنوان گیرنده الکترون در مرحله نهایی سیستم انتقال الکترون).
تمام باکتری های هوازی انرژی خود را بوسیله تنفس بدست میآورند، تنفس فرآیندی است که مسئول اکسیداسیون سوبستراهای مختلف میباشد. زنجیره تنفسی یک سکانس از آنزیمها و حاملین است که مسئول انتقال عوامل احیاکننده هم ارز و هم توان از سوبستراها به اکسیژن ملکولی میباشد. اکسیژن ملکولی از طریق مداخله یا پا درمیانی سیستم انتقال الکترون سوبسترای موردنظر را اکسیده میکند. اکسیژن گیرنده نهایی هیدروژن است بدینصورت که از هیدروژن تولید آب یا پر اکسید هیدروژن میگردد و این به گونه باکتری و سیستمهای آنزیمی آن بستگی دارد.
اکسیدازها برداشت هیدروژن از سوبسترا را کاتالیز میکنند اما از اکسیژن فقط بعنوان گیرنده هیدروژن استفاده میکنند.
سیستم سایتو کروم معمولا فقط در ارگانیسمهای هوازی وجود دارد که به آنها اجازه میدهد از اکسیژن بعنوان یک پذیرنده نهائی هیدروژن استفاده کنند تا اکسیژن ملکولی احیا شده و به پر اکسید هیدروژن تبدیل گردد. (آخرین حلقه در زنجیره تنفس هوازی).
استیل (Steel) دریافت که تمام ارگانیسمهای اکسیداز مثبت غیر از ویبریو فتوس (که اکنون در جنس کامپیلو باکتر جای دارد) که میکرو آئروفیلیک است، همگی هوازی و یا بصورت اختیاری بیهوازی میباشند.
گوردون و مک لئود (Gordon & Macleod) خاطر نشان ساختند که واکنش اکسیداز مثبت محدود به ارگانیسمهائی است که بتوانند در حضور اکسیژن رشد کرده و آنزیم کاتالاز تولید کنند، پراکسید هیدروژن که تجمع آن سمی است توسط آنزیم کاتالاز تجزیه میگردد.
![]()
ارگانیسمهای بیهوازی اجباری فاقد فعالیت اکسیداز هستند. این ارگانیسمها بدلیل آنکه فاقد سیستم سایتوکروم اکسیداز میباشند در حضور اکسیژن موجود در اتمسفر نمیتوانند زنده بمانند.
دیبل و اوانس (Deibel & Evans) نشان دادند که گونههای لاکتو باسیل فاقد این آنزیم میباشند.
سیستم سیتوکروم اکسیداز بین گونههای باکتریایی فرق میکند، برخی از ارگانیسمها فقط یک نوع آنزیم دارند در حالیکه برخی دیگر ممکن است ۲ یا ۳ نوع اکسیداز تولید نمایند.
![]()
سیتو کروم های دیگر (غیر از سیتوکروم اکسیداز نهایی) آنزیمهایی هستند که همگی مسئول نتیجه آزمایش (اکسیداز) مثبت میباشند. تولید این دونوع آنزیم در جنسهای مختلف باکتریها فرق میکند.
تصور میشود که گونههای نایسریا اندوفنل اکسیداز تولید نمایند در حالیکه گونههای سودوموناس سیتوکروم، اکسیداز تولید مینمایند. مطالعات اسپکتروفتومتریک ثابت کرده است که سایتوکروم اکسیداز (Warburgs Cytochrome Oxidase) و اندوفنل اکسیداز یکی هستند.
گابی و هادلی (Gaby&Hadley) اسامی دیگری را نیز برای سیتوکروم اکسیداز بر میشمارند: Atmungsferment، سیتوکروم C اکسیداز، سیتو کروم a3 اکسیداز و سیتو کروم a اکسیداز.
کاستور و چنس (Castor & Chance) با روش فتوشیمیایی نشان دادند که ۴ پیگمان باکتریایی بعنوان آنزیمهای تنفسی سیتو کروم اکسیداز انتهایی – عمل میکنند: سیتوکروم a1، سیتوکروم a2، سیتوکروم a3، و یک پیگمان باند شده با منوکسید کربن (Co- binding) که بعنوان سیتوکروم O در نظر گرفته شده است.
سیتوکرومهای a و a3 دریک پروتئین بصورت ترکیب شده وجود دارند و این کمپلکس سیتو کروم aa3 نامیده میشود. مخلوطی از سیتوکروم a و سیتوکروم a3، سیتوکروم C اکسیداز نام دارد.
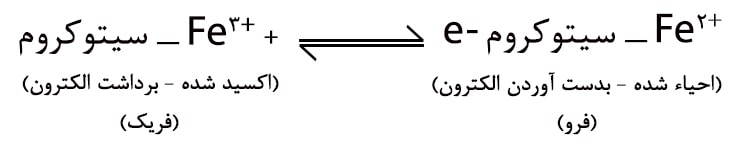
سیتوکروم ها پیگمانهای تنفسی هستند که حاوی ترکیبات آهن پورفیرین میباشند. سیتوکروم aa3 شامل ۲ ملکول هم A است که هر یک دارای یک اتم آهن میباشد. این اتم آهن در طول اکسیدآسیون و احیاء به حالت فریک (+++Fe) و فرو (++Fe) پس و پیش میرود (اصطلاحا تاب میخورد)، همچنین دو اتم مس (++Cu) با فعالیت سیتوکروم اکسیداز و واکنش الکترونها با اکسیژن ملکولی در ارتباط میباشد.
تمام گونههای سودوموناس و نایسریا آنزیم اکسیدازی تولید میکنند که در حضور اکسیژن اتمسفر، سیتوکروم C و یک معرف اکسیداز معرف را اکسیده کرده و به یک ترکیب رنگی تبدیل میکنند. (اندوفنل).
الکترونها از سیتوکروم C توسط فرم اکسید شده سیتوکروم اکسیداز برداشت گردیده و به ملکول اکسیژن انتقال مییابند.
برای رژنراسیون غیر مستقیم سیتوکروم C اکسید شده وجود اکسیژن آزاد ضروری است.
این تست ( تست اکسیداز ) حضور سیتوکروم C را تائید میکند و تنها باکتریهایی که حاوی سیتوکروم C بعنوان یک آنزیم تنفسی میباشند در این تست واکنش مثبت میدهند.

پاسخ مثبت تست اکسیداز در حقیقت نتیجه یک سری از واکنشهای متوالی است که درآن یک جزء قابل اکسید شدن در سیستم سیتوکروم بعنوان کاتالیست نهائی وجود داشته است.
ممکن است سوبستراهای مصنوعی جایگزین گیرندههای الکترونی (در هر کجای زنجیره انتقال الکترون) طبیعی شوند. رنگهای معرف تستهای اکسیداز گیرندههای مصنوعی الکترون هستند، معرف پارافنیلن دی آمین و ایندوفنل هم گیرنده و هم دهندههای الکترونی میباشند. سوبستراهای مصنوعی ممکن است رنگی و یا بدون رنگ باشند و بهر حال در واکنش نهایی تست اکسیداز یک محصول رنگی تولید مینمایند.
۴- معرفهایی که در تست اکسیداز مورد استفاده قرار میگیرند:
الف: معرفهای اکسیداز
۱- معرف کواکس (Kovacs): تترامتیل پارا فنیلن دی آمین هیدروکلراید (TDP)،ء(N,N,N,N- ، تترامتیل- پارا- فنیلن دی آمین دهیدروکلراید) بصورت محلول ۰٫۵ و ۱ درصد (W/V) این محلول بیرنگ میباشد.
۲- معرف گوردن و مکلئود: دی متیل پارافنیلن دی آمین هیدروکلراید ۱ تا ۱/۵ درصد (N,N- دی متیل پارافنیلن دی آمین منوهیدروکلراید) یا پاراآمینودی متیل آلانین منوهیدروکلراید، رنگ محلول ارغوانی روشن است.
۳- معرف گابی و هادلی، اصلاح شده توسط اوینگ و جانسون:
الف- معرف A : آلفانفتول به مقدار ۱ % در اتیل الکل ۹۵ %
معرف B : پاراآمینودی متیل آنیلین هیدروکلراید (یا اگسالات)
(نام دیگر: دی متیل پارافنیلن دی آمین اگسالات) به مقدار ۱ %
ب- همچنین به عنوان معرف ایندوفنل اکسیداز مطرح میباشد.
ج- واکنش *na: nadi از نفتول (naphthol) و di از diamine گرفته شده است.
۴- معرف کارپنتر، زورلاند و موریسون: پاراآمینودی متیل آنیلین اگسالات ۱%
۵- دیسک یا استریپ آغشته به اکسیداز:
الف- دیفکو (difco):
- ۱Bacto-differentiation disks (معرف: پاراآمینو دی متیل آنیلین اگسالات)
- Dryslide oxidase test (معرف: N,N,N,N- تترامتیل پارا فنیلن دی آمین دهیدروکلراید)
ب- بی بی ال (BBL):
Taxo N Discs ( معرف: پارا آمینودی متیل آنیلین)
ج- Key Scientific Products
دیسک و نوار (Strip )
معرف: N,N,N,N- تترامتیل پارافنیلن دی آمین دهیدروکلراید
د- REMEL: Microdase test disks
۱- اکسیداز اصلاح شده : استافیلکوک (-) رااز میکروکوکوس (+) جدا مینماید.
۲- دیسکهای کاغذ فیلتری با معرف اکسیداز (تترا) در دی متیل سولفوکساید، دی متیل سولفوکساید باعث افزایش نفوذپذیری سلول نسبت به معرف میشود.
۳- تلقیح میکروب : بوسیله اپلیکاتور کلنی از محیط کشت برداشته شده و روی دیسک مالیده میشود.
۴- نتایج:
الف- تمام استافیلوکوک ها به استثنای استرینهای S.caseolyticus ،S.sciuri ،S.lentus و S.vitulus منفی هستند.
ب- halobia Nesterenkonia ،Dermacoccus nishinomiyaenis و Arthrobacter agilis اکسیداز (+) هستند. تمام این گونهها قبلا در جنس میکروکوکوس قرار داشتهاند.
ب: روش تهیه معرفهای تست اکسیداز:
۱- از معرف دلخواه و مورد نظر مقدار ۱ گرم در کمتر از ۱۰۰ میلیلیتر آب مقطر حل کنید ( استثنا: آلفانفتول به میزان ۱ گرم در ۱۰۰ میلیلیتر اتیل الکل ۹۵% حل میشود)
۲- مخلوط را خوب گرم کنید تا کاملا به صورت محلول درآید.
۳- محلول را به یک فلاسک حجمی (۱۰۰ میلیلیتری) منتقل کرده و با آب یا اتانول (رقیقکننده مناسب) به حجم برسانید.
۴- قبل از استفاده اجازه دهید محلول به مدت ۱۵ دقیقه بهحال خود باقی بماند.
۵- محلول تهیه شده را در یک ظرف دربدار و تیره رنگ نگهداری نمائید بهتر است در معرض نور قرارنگیرد.
۶- برچسب مناسبی روی آن قرار دهید.
معرف کواکس: محلول آبی ( مائی) یک درصد از تترامتیل پارا فنیلن دی آمین نسبت به ترکیب دی متیل دارای سمیت کمتری است و از طرف دیگر از حساسیت بیشتری نیز برخوردار میباشد. (و البته گرانتر نیز میباشد) این معرف در کلنیهای اکسیداز (+) رنگ ارغوانی تولید مینماید که بتدریج ارغوانی تیره و متمایل به سیاه میگردد اما ممکن است رنگ به محیط اطراف کلنی نیز سرایت نماید.
معرف گوردون و مک لئود: محلول آبی ۱ تا ۱/۵ درصد دی متیل پارافنیلن دی آمین، نسبت به ترکیب تترامتیل پایدارتر است. تمام ترکیبات پارافنیلن دی آمین نسبتا ناپایدار میباشند.
معرف پارا آمینو دی متیل آنیلین اگسالات نسبت به معرف کواکس یا گوردون و مک لئود یک مزیت دارد و آن این است که هم بحالت پودری و هم به فرم محلولی دارای پایداری زیادی است، محلول آبی آن حداقل بمدت ۶ ماه پایدار است.
قابلیت حل شدن پارا آمینودی متیل آنیلین اندکی کمتر از معرفهای حاوی نمک هیدروکلراید است اما گرم کردن ملایم باعث حل شدن آن میگردد. مزیت دیگر آن این است که موقعی که روی کلنیهای رشد کرده در محیط کشت شکلات آگار شناور میشود، نمک اکسیداز ایجاد رسوب سیاه رنگ نمیکند.
در حالیکه در مورد معرفهای حاوی نمک هیدروکلراید گاهی اوقات چنین اتفاقی میافتد.
استفاده از دیسکها یا نوارهای آغشته به اکسیداز تجارتی ضرورت تهیه معرفهای تازه را برطرف مینماید. هیچیک از این معرفها با واکنش رنگ آمیزی گرم مداخله نمیکنند.
ج-روش استفاده از معرفها:
۱– معرفهای محلول
الف- روش مستقیم با استفاده از محیط کشت شیبدار با معرفهای ایندوفنل (راکسیون nadi)
- محیط رشد میکروب: آگارنوترینت شیبدار: کشت ۱۸ الی ۲۴ ساعته
- دو تا سه قطره از معرفهای A و B به روی سطح شیبدار آگار بیفزائید و بعد لولهها را کج کرده بهطوریکه معرفها مخلوط شده و روی کلنیها جاری گردند.
- تغییر رنگ را مشاهده کنید. رنگ آبی روی کلنیها در عرض ۲ دقیقه بیانگر واکنش (+) است.
ب- روش مستقیم داخل پلیت
- دو تا سه قطره معرف را مستقیما روی چند کلنی مشکوک که در پلیت رشد کرده است بریزید. (از محیط کشت ژلوز خوندار یا محیط کشت ژلوز شکلاتی استفاده نمایید).
- اجازه ندهید که تمام سطح پلیت بوسیله معرف آغشته شود.
- پلیت را برنگردانید.
- تغییر رنگ را مشاهده کنید.
a) معرف کواکس: واکنش رنگی به فاصله ۱۰ الی ۱۵ ثانیه
b) معرف گوردون و مک لئود: واکنش رنگی به فاصله ۱۰ الی ۳۰ دقیقه
c) روش غیر مستقیم با کاغذ صافی بکمک معرف کواکس:
۱- یک قطعه کاغذ واتمن شماره ۱ به ابعاد ۶ سانتی متر مربع در پتری دیش قرار دهید
۲- دو تا سه قطره از معرف کواکس در مرکز کاغذ بریزید.
۳- بهکمک سوزن یا سیم پلاتینی یک لوپ پر از کلنی مشکوک برداشته و روی کاغذ آغشته به معرف گسترشی بصورت یک خط بطول ۳ تا ۶ سانتی متر ایجاد نمائید.
۴- واکنش رنگی (+) در فاصله ۵ الی ۱۰ ثانیه ظاهر خواهد شد.
۲- دیسکهای اکسیداز:
a- روش مستقیم پلیت:
- دیسکهای آغشته به معرف را با آب مقطر استریل مرطوب کنید.
- دیسک مرطوب شده را روی چند کلنی مشکوک (در محیط کشت ژلوز خوندار و یا محیط کشت آگار شکلاتی) قراردهید.
- پلیت را برنگردانید.
- پلیت را برای مدت ۲۰ الی ۳۰ دقیقه در انکوباتور ۳۵ درجه قرار دهید. این تست را می توان در دمای اتاق (۲۵درجه سانتیگراد) و یا یخچال (۱۰-۴ درجه سانتیگراد) نیز انجام داد اما در اینصورت واکنش آهسته و کند تر خواهد بود.
- تغییر رنگ را مشاهده کنید: واکنش فوری به رنگ قرمز تا صورتی و بعد از گذشت ۲۰ الی ۳۰ دقیقه به رنگ قرمز تا سیاه دیده میشود.
b- روش غیر مستقیم:
۱- به دو حالت میتوان انجام داد:
الف- دیسک را با آب مقطر استریل مرطوبکرده در یک پتریدیش قرار دهید و سپس یک لوپ پر از کلنی مشکوک که در محیط کشت آگار رشد کرده به آن بیفزائید.
ب- دیسک را با آبگوشت محتوی میکروارگانیسمی که در آن رشد کرده مرطوب کنید.
۲- تغییر رنگ صورتی تا سیاه را مشاهده نمائید، راکسیون (+) میباید در فاصله چند ثانیه اتفاق افتد
۳- تست سواب:
a- برای انجام آزمایش در مورد باکتری های سخت گیر
b- معرف: تترامتیل پارافنیلن دی آمین هیدروکلراید
c- بعوض لوپ باکتریولوژی سوزن یا میله و اپلیکاتور بهتر است از یک سواب سرپنبه ای سفید استفاده نمائید.
d- با کمک سواب کلنی را برداشته و روی یک قطعه کاغذ فیلتری که محتوی معرف است بمالید.
e- نتیجه تست را روی سواب تفسیر کنید و نه روی کاغذ فیلتر.
- راکسیون (+) در فاصله ۱۰ الی ۱۵ ثانیه ایجاد میشود. واکنش ضعیف یا تاخیری موقعی است که تغییر رنگ بیش از ۳۰ ثانیه ولی حتما” درطول ۱ دقیقه پدید آید.
- ممکن است نتیجه تست روی سواب (+) ولی روی کاغذ فیلتر منفی باشد. (جواب روی سواب قابل اعتماد است)
د-کنترل کیفی:
هر معرف یا دیسک میباید قبل از استفاده با نمونه کشتهای شناخته شده دارای واکنش (+) و منفی آزمایش شوند.
ه –نگهداری معرفها:
تمام معرفها و دیسکها را در یخچال (۴ درجه سانتیگراد) نگهداری نمائید. قبل از استفاده آنها را گرم نمائید (به دمای آزمایشگاه برسانید) Bernsohn و Barry توصیه میکنند که معرفها در دمای ۲۰- درجه سانتیگراد در مقادیر ۱ تا ۲ میلیلیتری نگهداری شوند و ۳ الی ۴ ساعت قبل از مصرف ذوب گردند (به جهت کاهش میزان اتواکسیداسیون معرفها که بتوان فعالیت آنها را برای مدت طولانی حفظ نمود).
بعد از ذوب شدن معرفها فقط بمدت یکروز قابل استفاده خواهند بود.
تمام معرفها میباید بلافاصله قبل از مصرف تهیه شوند، در حالت محلولی بسرعت غیر فعال میشوند و در صورتی که در یخچال نگهداری شوند ممکن است بین ۵ روز الی ۲ هفته بصورت پایدار باقی بمانند.
برطبق نظر آزمایشگاههای دیفکو (Difco) معرف پارا آمینو دی متیل آنیلین اگسالات بمدت ۶ ماه پایدار است. اگر چه از آنجا که میزان پایداری این معرفها فرق میکند، عاقلانهتر این است که در مورد دیسکها و معرفها آزمایشهای کنترل کیفیت بصورت هفتگی بعمل آید و در صورتیکه نتایج منفی و یا راکسیونهای ضعیفی (با ارگانیسمهای شناخته شده واکنش مثبت) مشاهده شد، دور ریخته شوند.
در صورتی که در اثر نگهداری طولانی، دیسکها کدر شوند، فعالیت اکسیداز کاهش یافته است.
و- اساس شیمیایی را کسیون معرفها :
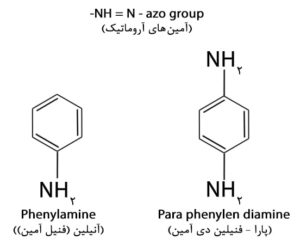
رنگهای پارافنیلن دی آمین اساسا آمینهای آروماتیک-مشتقات دی آمینو از بنزن-میباشند.
سیتوکروم اکسیداز مستقیما با معرف پارافنیلن دی آمین واکنش نمیدهد بلکه سیتوکروم c را اکسیده مینماید و نهایتا معرف اکسیده میشود.

ترکیب اصلی یا اساسی معرفها، فنیلن دی آمین متیله شده است.
اگر گروههای متیل بیشتری به ریشه آمین (NH2) معرفی شوند، رنگ معرف آبیتر و اگر ۳ گروه فنیل (C6H5) بجای متیل معرفی شده باشد رنگ معرف پر رنگتر (deeper) میشود.
اکسیداسیون آمینهای آروماتیک سبب تولید کینونها (quinines) میشود. اگر معرف اکسیداز با آلفانفتول تهیه شده باشد اندوفنل آبیرنگ ایجاد میشود اگر چه آلفانفتول برای انجام واکنش ضروری نیست نفتول یک جزء جفت شونده آزوئیک است:
دو نوع عمده تستهای اکسیداز وجود دارد که از معرفهای مختلفی استفاده میکنند اما مکانیزم و نتایج آنها قابل مقایسهاند:
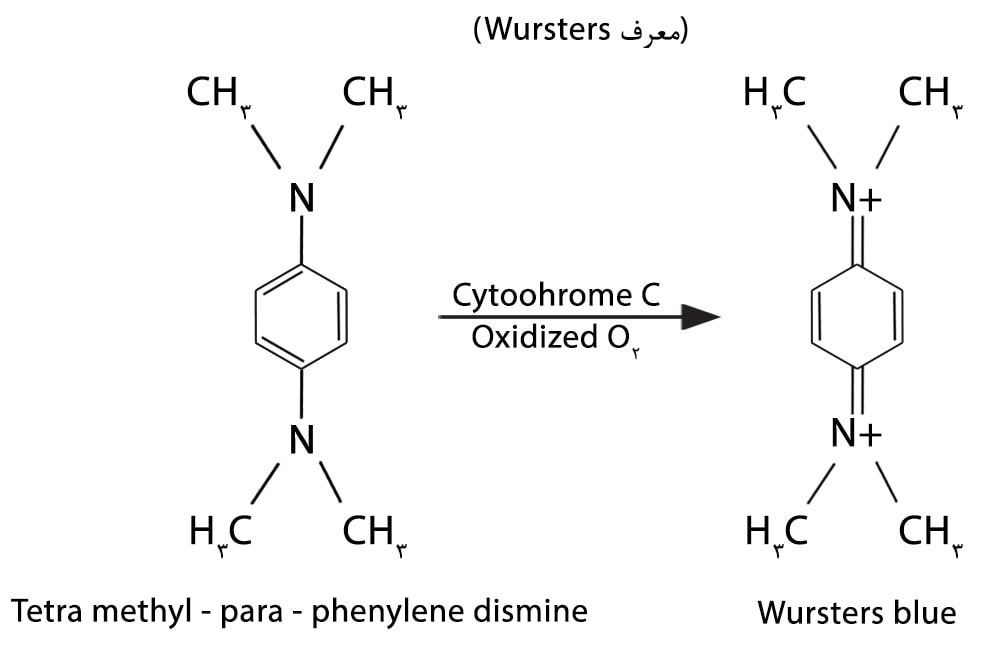
Wursters blue در حضور اوزون یا پراکسید هیدروزن تشکیل میشود.
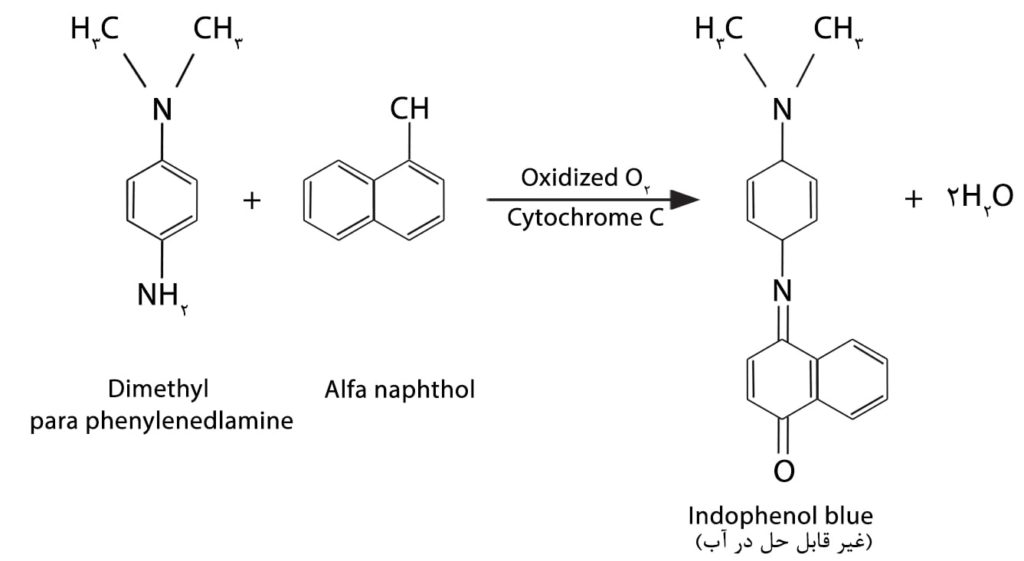
اندوفنل یک رنگ و یک N-analog برای کینون (quinone) میباشد که در آن N= با یک یا دو گروه O= جانشین شده است.

معرف فنیلن دی آمین هیدروکلراید یک گروه دی کلرومید (NCL=C6 H4=CLN ) ایجاد میکند.
NCL=به NH2– احیاء میشود و یا اینکه هیدرولیز شده تبدیل به O= میگردد.
۵-ارگانیسمهای مفید جهت کنترل کیفیت:
الف: واکنش مثبت (+):
نایسریا موکوزا (۱۹۶۹۶ ATCC)
سودوموناس آئروجینوزا (ATCC 10145)
ب: واکنش منفی (-):
اشریشیا کولی (ATCC 11725)
۶- تفسیر تست اکسیداز:
الف: کلنیهای اکسیداز (+):
کلنیها به رنگ صورتی و سپس قرمز تیره و نهایتا سیاه (ارغوانی مایل به سیاه) در میآیند.
۱- کلنیهای صورتی:
a- باکتریهای زنده
b- مرحله تجدید کشت
۲- کلنیهای سیاه:
a- در طول ۱۰ الی ۱۵ ثانیه
b- باکتریهای غیر زنده
موقعی که از مخلوط معرفهای دی متیل پارافنیلن دی آمین و آلفا نفتول استفاده میشود نتیجه مثبت توسط تولید رنگ آبی در فاصله ۱ الی ۲ دقیقه مشخص میگردد.
ب- کلنیهای اکسیداز منفی (-):
۱- هیچگونه تغییر رنگی در کلنیها دیده نمیشود و یا اینکه رنگ صورتی روشن مربوط به معرف دیده میشود.
۲- تغییر رنگ (سیاه شدن) اطراف محیط کشت ممکن است دیده شود. با معرف کواکس نتیجه مثبت توسط رنگ ارغوانی متمایل به سیاه که در فاصله ۱۰ ثانیه ظاهر میشود مشخص می گردد. واکنش (+) در فاصله ۱۰ الی ۶۰ ثانیه بعنوان نتیجه (+) تاخیری در نظر گرفته می شود. گسترش ( یا ظهور) رنگ بعد از ۶۰ ثانیه بیانگر نتیجه منفی است (Steel)
نوارهای آغشته به معرف اکسیداز (Barry and Bernsohn):
الف- آمادهسازی نوار (استریپ):
- کاغذ واتمن شماره ۱
a- بصورت نوارهایی به طول ۶ سانتیمتر ببرید.
b- با محلول آبی دی متیل پارافنیلن دی آمین اگسالات یک درصد آغشته نمایید. - به سرعت خشک کنید.
a- به نخ یا میله های شیشه ای مناسب آویزان کنید.
b- از تماس فلز مانند کلیپس، گیره، پونزو….. اجتناب شود. - در جار دربداری که محتوی مقدار زیادی ماده خشک کننده است قرار دهید.
- در یخچال نگهداری نمایید (پایداری بمدت ۶ ماه میباشد).
ب- روش انجام آزمایش:
- از کلنی های خالص روی استریپ خشک گسترش تهیه نمائید.
- تعدادی کلنی می توان بطور همزمان روی همان نوار کاغذی مورد آزمایش قرار داد.
ج – تفسیر:
- نتایج در فاصله ۱۰ ثانیه خوانده میشود: واکنش (+) : تولید رنگ قرمز
۷- احتیاطات در تست اکسیداز:
الف: تست اکسیداز بصورت روتین برای شناسایی اعضاء جنس نایسریا بکار میرود اگر چه جنسهای دیگر هم موجب مثبت شدن آزمایش میشوند.
Ellingworth و همکارانش دریافتند که هموفیلوس آنفلوآنزا با معرف دی متیل پارافنیلن دی آمین پاسخ اکسیداز منفی میدهد آما با معرف کواکس (تترامتیل پارافنیلن دی آمین) که بسیار حساستر است پاسخ اکسیداز (+) نشان میدهد.
Castor&Chance بیان کردند که سودو موناس مالتوفیلیا اغلب اکسیداز مثبت تاخیری است و تمام گونههای سودوموناس اکسیداز (+) نیستند. آنها توصیه کردند که برای توصیف جنس سودو موناس از راکسیون اکسیداز استفاده نشود.
استفاده از تست اکسیداز بهعنوان کمک در شناسایی جنس نایسریا منوط به آن است که تمام کلنیهای اکسیداز (+) با روش گرم رنگ آمیزی شوند. (تمام گونههای نایسریا گرم منفی هستند و دیپلوکوکهایی به شکل دانه قهوه میباشند). ارگانیسمهای دیگر که ممکن است نتیجه تست اکسیداز مثبت داشته باشند باسیلهای گرم منفی و یا کوکو باسیلهای گرم منفی میباشند. باید دانست که Oligella urethralis که نام قبلی آن Moraxella urethralis است در رنگ آمیزی گرم از نظر مرفولوژی مشابه نایسریا میباشد. بنابراین برای شناسایی نهایی گونههای نایسریا انجام تستهای تخمیر کربوهیدرات الزامی است.
ب: تست اکسیداز را روی هر کلنی که در محیط کشت حاوی گلوکز رشد کرده باشد نباید انجام داد زیرا تخمیر گلوکز باعث مهار فعالیت اکسیداز میشود و ممکن است به نتایج منفی کاذب منجر شود.
تست اکسیداز برای باسیلهای گرم منفی میباید فقط در محیطهای غیر انتخابی (non selective) و یا غیر افتراقی (non differential) از قبیل محیطهای کشت زیر انجام شود تا جوابها دارای اعتبار لازم باشند:
ژلوز خوندار، تریپتیکیس سوی آگار، نوترنیت آگار Heart infusion Agar و در محیطهای EMB ،MAC، XLD و BGA نباید انجام گیرد.
ج: Lautrop خاطر نشان میسازد که جوابهای مثبت کاذب در مورد بوردتلا پرتوزیس هنگامی که در محیط کشت آگار خوندار کشت میشوند ممکن است دیده شود.
د– برای انجام تست اکسیداز توصیه شده است که از لوپ یا سوزن پلاتینی و یا اپلیکاتور مناسب برای برداشت کلنیها استفاده شود. بنا به گفته Steel مقادیر جزئی از آهن (نیکروم) به تنهایی قادر است معرف فنیلن دی آمین را اکسیده نموده در نتیجه باعث ایجاد مثبت کاذب گردد.
ه- در شرایطی که در یک محیط کشت دو جنس سودو موناس و نایسرها بصورت مخلوط وجود داشته باشند ممکن است نتایج منفی کاذب بدست آید. زیرا گونههای سودو موناس ماده مهارکنندهای تولید میکنند که در تولید اکسیداز توسط گونههای نایسریا مداخله میکند.
و- تغییر رنگ (سیاه شدن) در محیط کشت اطراف کلنیها ارزشی ندارد. هنگامیکه از معرف کهنه هیدروکلراید در محیط کشت آگار شکلاتی استفاده میشود ممکن است یک رسوب سیاه رنگ در اطراف کلنی دیده شود. تغییر رنگ روی کلنیها در تفسیر نتیجه تست اکسیداز ارزشمند است. راکسیون را روی کلنیهای تست شده مشاهده کنید. در مواردی که از نمک اگسالات استفاده شده باشد چنین رسوبی تشکیل نمیشود. بنابراین ملح اگسالات به نمکهای منوودی هیدروکلراید ترجیح داده میشود. از طرف دیگر اگسالات بسیار پایدارتر است و معمولا بصورت هفتگی تهیه میشود در صورتیکه هیدروکلراید باید روزانه تهیه شود.
ز– با توجه به اینکه معرف دیگری بنام کواکس اندول (Kovacs indole) وجود دارد بنابراین برای معرف تترامتیل پارافنیلن دی آمین دی هیدروکلراید برچسبی تهیه کنید که با کواکس اندول اشتباه نشود. توصیه میشود که روی برچسب بنویسید : معرف کواکس اکسیداز (eKovacs oxidas)
ح- معرفهای اکسیداز به سرعت با اکسیژن آزاد موجود در هوا به طور خودبخودی اکسیده میشوند (اتواکسیداسیون) و حساسیت خود را از دست میدهند. میتوان با افزودن محلول ۰٫۱ % از اسید اسکوربیک در هنگام تهیه معرف، سرعت اکسیداسیون خود بخودی معرف را کاهش داد.
باید توجه داشت که در صورت بوجود آمدن هر گونه رسوبی میباید معرف دور ریخته شود . از هرگونه تماس بیجا، نامناسب و بیش از حد معرفها با نور خودداری شود.
اگر رنگ معرف تترامتیل کواکس آبی پر رنگ شود باید دور ریخته شود. این محلول باید بی رنگ باشد.
زمان مربوط به انجام واکنش باید دقیقا رعایت شود. رنگ ارغوانی متمایل به سیاه ممکن است بعدا بدلیل اتواکسیداسیون معرفها و یا بدلیل وجود ارگانیسمهایی با واکنش مثبت ضعیف (که حاوی مقدار کمی سیتوکروم C هستند) بوجود آید.
ط– در مورد واکنشهای + با معرف کواکس تترامتیل فقط در صورتی که زمان (تا ۶۰ ثانیه) در مورد آن رعایت شود قابل اطمینان و معتبر است.
معرف کواکس بسیار حساس است و زمان قرائت نهایی تست در طول ۱۰ ثانیه است. هر نتیجهای بعد از ۱۰ ثانیه و حداکثر تا ۶۰ ثانیه برای گونههای نایسریا ارزشمند نیست. اگر چه در مورد معرف دی متیل ممکن است به زمان بین ۱۰ تا ۳۰ دقیقه برای واکنش اکسیداز مثبت نیاز داشته باشیم. در صورت ایجاد یک راکسیون تاخیری، آزمایش میباید با استفاده از کشت ۱۸ تا ۲۴ ساعته در ژلوز خوندار تکرار شود.
ی- مطالعات اسپکتروفتومتریک نشان دادهاند که سیتوکروم اکسیداز واندوفنل اکسیداز یکی هستند.
ک– در صورت استفاده از معرفهای A و B تست اندوفنل (nadi) از هرگونه واکنش ضعیف یا مشکوک بعد از ۲ دقیقه چشم پوشی نمائید.
ل– با توجه به اینکه حساسیت دی متیل پارافنیلن دی آمین هیدروکلراید کمتر است بدلیل نفوذ ضعیف معرف در کلنیهای چسبناک، ممکن است این کلنیها نتیجه اکسیداز منفی کاذب نشان دهند.
م– با استفاده از روش غیرمستقیم کاغذ فیلتر یا دیسک، مقدار کافی از ارگانیسم زنده برای کشت مجدد و انجام تستهای بیوشیمیایی (تشخیص افتراقی) باقی میماند.
ن– تست اکسیداز یک واکنش اکسید کنندگی است و میباید به کلنیها اکسیژن برسد. بعد از شناور شدن کلنیها در معرف میباید کشت لولهای مورب یا پلیتها را کج کنید تا معرفها از سطوح کلنیها خارج شده و باعث مواجهه کلنیها با هوا گردد.
س– تست اکسیداز میباید در تمام باسیلهای گرم منفی انجام گیرد. اگر تست در مورد انتروباکتریاسهها انجام نشود ( تمام اکسیداز منفی هستند بجز P.shigelloides) این امکان وجود خواهد داشت که Aeromonas hydrophilia (+) بعنوان E.coli و یا P.shigelloides (+) و Serratia SP (+) بعنوان Shigella Sonnei اشتباها تشخیص داده شوند.
*ارلیخ: (Erlich) در سال ۱۸۵۵ بار واکنش اکسیداز را با تزریق مخلوطی از آلفانفتول و دی متیل پارافنیلن دی آمین به حیوانات مشاهده کرد و دریافت که در محل تزریق یک ماده آبیرنگ (آبی اندوفنل) تشکیل میگردد. این واکنش بنام نادی “nadi” خوانده شد.



کامل و مفید بود ممنونم از شما
خوشحالیم مطالب ارائه شده مورد توجه شما قرار گرفته است.