
روشهای بیوشیمیایی شناسایی آنتروباكترياسه ها (2)
ترجمه و تنظیم: دکتر محمد قهری
آزمایش متیلرد (MR)
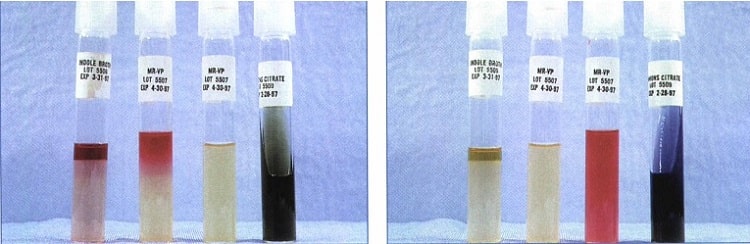
برای انجام این تست، باكتری مورد نظر را در محیط (MR-VP) كشت داده و بعد از 48 ساعت به آن به ازای هر یك میلیلیتر از محیط، یك قطره معرف تازه متیلرد میافزایند. چنانچه pH محیط كمتر از 4/4 باشد رنگ قرمز ظاهر میشود و نشانه مثبت بودن آزمایش (تخمیر اسیدی مخلوط) است. درصورتیکه pH بالاتر از 5 باشد، رنگ محیط زرد میشود که نشانه منفی بودن و احتمالاً واكنش تخمیر بوتیلن (الكلی) است. برای بدست آوردن نتیجه بهتر، محیط كشت را برای مدت 5 روز در 30 درجه سانتیگراد قرار میدهند. لازم بهذکر است که محیط MR-VP حاوی قند گلوكز و فسفات است و در راه تخمیر اسیدی مخلوط، انواع اسیدهای لاكتیك، استیك، فرمیك، سوكسینیک و الكل اتانول تولید میشود (شکل 1).

آزمایش ووگس-پروسكوئر (VP)
این واكنش ایجاد استیل متیل كربینول یا استوئین را از گلوكز در محیط نشان میدهد. بهطورکلی دو راه برای تخمیر گلوكز در باكتریها وجود دارد، اول تخمیر اسیدی مخلوط بوده كه مقدار زیادی اسید و كمی اتانول تولید میشود، دوم تخمیر بوتیلن گلیكول است كه در آن مقدار ناچیزی از اسیدهای مختلف تولید میگردد، ولی مقادیر زیادی بوتیلن گلیكول و اتانول بوجود میآید.
برای انجام این آزمایش، باكتری را در محیط MR-VP (آبگوشت حاوی گلوكز و فسفات) كشت داده و به مدت 48-24 ساعت (چنانچه کشت غلیظ صورت گیرد زمان کوتاه میشود) در دمای 37-35 درجه سانتیگراد قرار داده میشود. بعد از این مدت به ازای هر یک میلیلیتر از محیط كشت، 15 قطره محلول الكلی آلفا نفتول (محلول 5 درصد در اتانول 95%) و 10 قطره پتاس (40% در آب) اضافه میشود. پس از مخلوط نمودن به مدت 15 تا 30 دقیقه در انكوباتور 35 درجه سانتیگراد قرار داده میشود تا بروز رنگ صورتی-قرمز در محیط که نشانهی مثبت بودن واكنش است، مشاهده گردد. رنگ زرد کمرنگ نشاندهنده منفی بودن واکنش است. كلبسیلا، انتروباكتر و سراشیا، در این تست واکنش مثبت دارند (شکل 2).

آزمایش سیمون سیترات
بعضی از باكتریها قادر هستند انرژی مورد نیاز خود را از راههای دیگری (بهجز تخمیر كربوهیدرات) بدست آورند. سیترات سدیم، نمك اسید سیتریك بوده و باكتریها با استفاده از سیترات بهعنوان یك ماده غذایی و یا تنها منبع كربن، آن را مورد استفاده قرار میدهند. محیطی كه برای نشان دادن سیترات بكار میرود، تحت عنوان محیط سیمون سیترات (Koser) است. باکتریهایی كه دارای آنزیمهای سیتراتاز، سیتراز و سیترات لیاز هستند، میتوانند از سیترات استفاده نمایند. معرف این محیط بروموتیمول آبی است که در pH خنثی به رنگ سبز، در pH اسیدی (كمتر از 6) زرد و در pH قلیایی (بالاتر از 7/6) آبی رنگ میشود. برای انجام تست، باکتری را به میزان كم، ابتدا بر روی این محیط بهصورت سطحی كشت میدهند و سپس به مدت 48 ساعت در حرارت 37-35 درجه سانتیگراد قرار داده میشود. در صورت رشد باکتریها و ایجاد رنگ آبی، واکنش مثبت در نظر گرفته میشود (شکل 3).

آزمایش اورهآز
از محیطهای کشت مایع استوارت (buffered broth (Rustigian & Stuart urea broth و یا محیط جامد کریستنسن (Christensen’s urea agar) برای این منظور استفاده میشود. اوره یك دیآمید بوده و باکتریهایی كه دارای آنزیم اورهآز هستند، میتوانند اوره را مصرف نموده و تولید آمونیاك، دیاکسید کربن و آب نمایند. آمونیاك حاصل با تركیبات دیگر به كربنات آمونیم تبدیل شده و pH محیط قلیایی میگردد. معـــرف محیط فنلرد است كه در 6/8 = pH نارنجی و در 8/1 =pH صورتی سیر و بنفش رنگ میشود. برای انجام تست، باکتری را به میزان كم در ابتدا بر روی محیط جامد بهصورت سطحی و یک لوپ داخل محیط مایع كشت میدهند و سپس به مدت 24-18 ساعت در حرارت 37 درجه سانتیگراد قرار داده میشود. در صورت مثبت بودن، کل محیط مایع و سطح محیط جامد قرمز شده و در صورت منفی بودن تست، رنگ محیط زرد باقی میماند. در این تست از گونههای پروتئوس بهعنوان کنترل مثبت و از اشریشیا کلی بهعنوان کنترل منفی استفاده میشود. تلقیح بیشتر باكتری بر روی محیط كشت باعث افزایش سرعت در اخذ جواب میگردد. لولههای كشت را بعد از 10 دقیقه، 30 دقیقه، یك ساعت، و چند ساعت بعد از انكوباسیون میتوان بررسی كرد (شکل شماره 5).
كاربرد این تست علاوهبر تشخیص انواع آنتروباكترياسه ها در شناسایی و افتراق گونههای خاصی از بروسلا، یا به عنوان كمك در شناسایی مخمرهای كپسولدار و نیز به عنوان یك تست اضافی برای شناسایی انواع خاصی از كوكوباسیلهای گرم منفی میباشد.

آزمایش تولید H2S
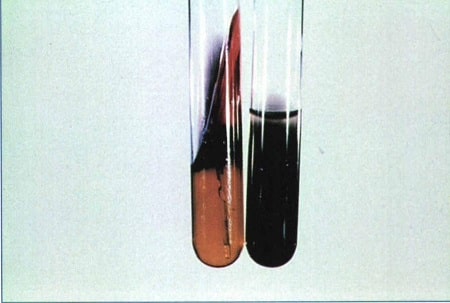
محیطهایی كه برای بررسی تولید گاز سولفید هیدروژن (H2S) بهكار میروند عبارتند از بیسموت سولفید، سیترات سولفید آگار، LIA (لیزین آیرون آگار) ،KIA ،TSI و SIM. تولید H2S همچنین در محیط XLDء،HEء،SS و با نوار استات سرب میتواند سنجیده شود. لازم به ذکر است که محیط SIM در مقایسه با محیطهای KIA ،TSI حساسیت بیشتری برای سنجش H2S نشان میدهد (شکل 6). هرچند که حساسیت استات سرب بیشتر از محیط SIM است و اغلب برای مواقعی که میزان تولید H2S کم است (در شناسایی بروسلاها) بکار میرود. مشاهده رنگ سیاه در محیط کشت نشانه تولید گاز H2S است.
محیط SIM
محیط SIM یک محیط نیمهجامد بوده و كشت باكتری در آن بهصورت عمودی و عمقی صورت میگیرد. این محیط، علاوهبر نشان دادن حركت و تولید ایندول، تولید H2S را نشان میدهد. در این محیط باكتریها مواد مختلف حاوی سولفور را مصرف نموده (پپتون، متیونین، سیستئین و تیوسولفات سدیم) و در نتیجه تولید H2S مینمایند كه این گاز تولیدشده با یون فریك ایجاد سولفیت فرو سیاهرنگ مینماید (شکل6).
آزمایش ایندول
بعضی از باكتریهای خانواده آنتروباكترياسه نظیر اشریشیا كلی كه دارای آنزیم تریپتوفاناز هستند، میتوانند از اسید آمینهی تریپتوفان گاز ایندول تولید نمایند. برای بررسی قابلیت تولید گاز ایندول، باكتری را در محیط دارای تریپتوفان (1%) (آبگوشت تریپتون توصیه شده است) كشت داده و به مدت 24 ساعت در حرارت 37 درجه سانتیگراد قرار میدهند، سپس به قسمت سطح لوله محیط کشت چند قطره معرف كواكس (Kovac) یا معرف ارلیش-بوهمه (Ehrlich-Boeheme) اضافه مینمایند. در صورت وجود گاز ایندول، 2 دقیقه بعد از اضافه کردن معرف، حلقه قرمز رنگی در سطح محیط تشكیل میشود (شکل 7). بعد از چند دقیقه اسید کلریدریک موجود در معرف کواکس با پلاستیک کلاهک واکنش میدهد و تغییر رنگ حاصل میکند (زرد رنگ) و یا به رنگ قهوهای مایل به قرمز درمیآید که این واکنش منفی است. از محیطهایی مانند SIM، اورنیتین-موتیلیتی-تریپتوفان (OMT) و ایندول نیترات جهت بررسی تولید ایندول استفاده میشود.

آزمایش دکربوکسیلاز
باكتریها دارای آنزیمهایی هستند كه قادرند به گروه كربوكسیل آمینواسیدها حمله نموده و آن را بردارند. محیطهای اختصاصی حاوی اسیدهای آمینه اختصاصی لایزیـــن، اورنیتین و آرژینین بهطور معمول برای آنتروباكترياسه ها مورد استفاده قرار میگیرند. محیط كشت لایزین آیرون آگار (LIA) حاوی گلوکز، اندیکاتور pH (برموکرزول ارغوانی یا بنفش)، یك اسید آمینهی اختصاصی و همچنین فریك آمونیوم سیترات و تیوسولفات (برای نشان دادن H2S) است. نقش گلوكز در محیط بسیار مهم است، زیرا واكنشهای دكربوكسیلاسیون توسط آنزیم مربوطه در محیط اسیدی افزایش مییابد (لازم بذکر است که همه آنتروباكترياسه ها گلوكز مثبت هستند). برای انجام عمل دكربوكسیلاسیون باید شرایط مختلفی رعایت گردد از جمله: pH اسیدی و شرایط بیهوازی (لولههای كشت حاوی محیط مایع بوسیلهی پارافین استریل پوشانده میشوند چرا که در حضور اکسیژن جواب مثبت کاذب رخ میدهد). در صورت دكربوكسیله شدن اسیدآمینه، محصولات آمینـــــی آزاد میگردند و محیط قلیایی میگــــردد (pH قلیایی شده) و رنگ محیط ارغوانی باقی میماند و در صورتی که باكتری فاقد آنزیم مربوطه باشد، با مصرف گلوكز، محیط زرد رنگ میشود. برای انجام تست، كشت در عمق (بهصورت خطی) و سطح محیط به شکل زیگزاک صورت میگیرد و رنگ بنفش یا ارغوانی نشانه دكربوكسیله شدن لایزین است. این محیط فعالیت دآمیناسیون را هم نشان میدهد كه در صورت دآمینه شدن توسط باكتری محیط به رنگ قرمز مشاهده خواهد شد. بهطورکلی واکنش ایجادشده در محیط لایزین بدین شکل است که با باقی ماندن رنگ بنفش یا ارغوانی، باکتری لایزین مثبت است و چنانچه قسمت عمقی محیط به رنگ زرد درآید لایزین منفی خواهد بود. اگر عمق محیط کشت، قرمز رنگ گردد باکتری لایزین را دآمینه نموده است. توجه شود که نتیجه كشت پس از 4 روز فاقد ارزش است.

لازم بذکر است اگر از محیط LIA برای آزمایش لایزین دکربوکسیلاز استفاده میشود نیازی به اضافه کردن پارافین مایع نیست و تنها پس از تلقیح باکتری در سطح و عمق و بعد از انکوباسیون نتیجه قرائت میگردد. اگر عمق محیط کشت بنفش یا ارغوانی شد جواب مثبت و در صورتی که عمق زرد رنگ شد جواب آزمایش لایزین دکربوکسیلاز منفی است.
واكنشهای دآمیناسیون
باكتریهای جنس پروتئوس، مورگانلا، پروویدنسیا و آنهایی كه دارای آنزیم (ال آمینواسید اكسیداز) هستند، میتوانند تعدادی از اسیدآمینهها را دآمینه نموده و تولید آلفا-كتواسید نمایند که نقش مهمی در شناسایی باكتریهای خانواده آنتروباكترياسه ایفاء میكند. برای بررسی واكنشهای دآمیناسیون، بر روی محیط فنیلآلانین كه بهصورت مورب (slant) تهیه شده، مقدار زیادی باكتری كه از روی محیط جامد برداشت شده به شکل زیگزاک كشت داده (فقط در سطح مورب) و بـــه مدت 24-18 ساعت در حرارت 35 درجه سانتیگراد قرار میدهند، سپـس حدود نیم میلیلیتر (5-4 قطره) كلرور فریك 10% روی محیط كشت اضافه میگردد. در صورت مثبت بودن تست، اسید فنیل پیرویك تولیدشده با معرف كلرور فریك ترکیب شده و ایجاد پیروات فنیل فریك و رنگ سبز میکند.

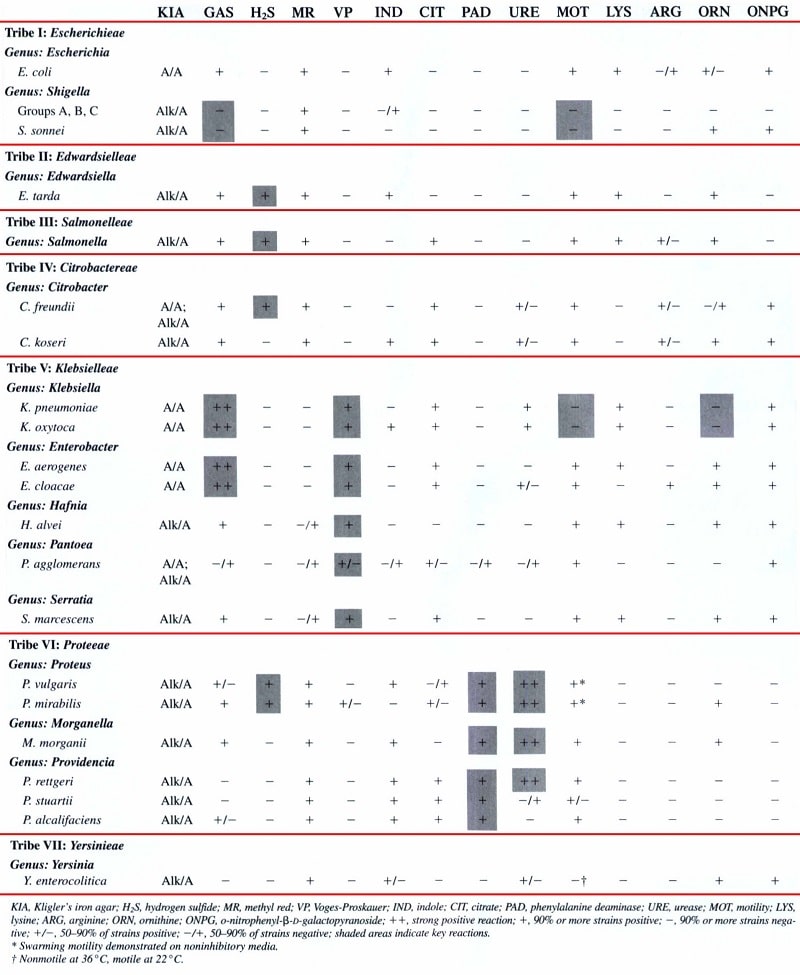
جدول 1: خصوصیات افتراقی کلیدی برای مهمترین آنتروباكترياسهها
سایر مقالات
تست های بیوشیمیائی برای تشخیص افتراقی گونههای شایع استرپتوکوکی
تستهای بیوشیمیایی برای شناسایی افتراقی گونههای شایع استافیلوکوکی
مروری بر تستهای بیوشیمیایی برای تشخیص کوکسیهای گرم مثبت
اختلاف های بین باکتری های گرم مثبت و باکتری های گرم منفی




توضیح عالی و کامل بود ممنون??
سلام، چرا محیط سیمون سیترات به صورت اسلنت تهیه میشه؟
با سلام.
در متن مربوطه تصویری که از محیط سیترات نشان داده شده، فرم مایع یا آبگوشتی از محیط سیترات است اما هنگام استفاده از فرم جامد یا دارای آگار، چنانچه در لوله استفاده شود نظیر سایر محیط های کشت افتراقی ِ جامد، بصورت اسلنت تهیه میشود.
در فرم اسلنت، هنگام تهیه، محیط زودتر سرد می شود، و هنگام استفاده، واکنش شیمیائی بهتر و واضح تر دیده می شود.