مروری بر روشهای بیوشیمیایی برای شناسایی باکتریهای گرم منفی
تهیه و تنظیم: دکتر محمد قهری
برای مطالعه و شناسایی میکروارگانیسمها باید به طریقی آنها را بر روی محیطهای مناسب از نظر شرایط فیزیکی و شیمیایی کشت داد. مطالعات فراوان درباره میکروارگانیسمها و نحوه زندگی آنها باعث شده که تاکنون انواع زیادی از محیط های کشت با ترکیبات متفاوت برای استفاده در آزمایشگاههای میکروبیولوژی تهیه شود. برای شناسایی هر دسته یا گروه از میکروارگانیسمها از محیط های کشت ویژه و معرفها و مواد شیمیائی اختصاصی استفاده میشود.
مراحل کلی جداسازی باکتری ها از نمونهها
در مورد جداسازی[۱] یک میکروارگانیسم همانطور که از خود کلمه مشخص است به معنای جدا کردن و ایزوله کردن یک میکروب از جمعیتهای مخلوط است که در طبیعت و در اکوسیستمها در کنار یکدیگر میانکنشهای مختلف دارند. در بحث جداسازی یک میکروارگانیسم و یا گروه میکروبی خاص، بهعنوان هدف در نظر گرفته میشود و روش بهگونهای طراحی میشود که بتوان درنهایت آن میکروب یا گروه میکروبی را بهصورت مجزا (ایزوله) در آزمایشگاه بدست آورد. جداسازی میکروارگانیسمهای مختلف دستورالعملهای خاص خود را دارد ولی آنچه در ابتدای چنین مبحثی لازم به توضیح است مراحلی است که تقریباً در بین تمامی انواع جداسازیها ثابت هستند.
غنیسازی: در این مرحله جمعیت میکروبی خاص و موردنظر که ممکن است در بین سایر میکروارگانیسمهای موجود در نمونه تعداد قابلتوجهی نداشته باشد را به روشی خاص مانند کشت در محیط کشت مناسب و غنی افزایش میدهند.
کشتهای انتخابی: بهعنوان مرحله دوم در جداسازی یک میکروارگانیسم معمولاً از محیط کشت های انتخابی برای جلوگیری از رشد سایر میکروارگانیسمهای مزاحم استفاده میشود.
خالصسازی: در این مرحله لازم است میکروارگانیسمهای انتخابشده و رشدکرده در مرحله قبل بهصورت کشت خالص تهیه شود و برای شناسایی و یا هرگونه آزمون میکروبی دیگر آماده شوند. معمولاً از روش کشت خطی برای گرفتن تککلنیهای باکتریایی استفاده میشود.
شناسایی: برای شناسایی میکروارگانیسم جداشده از روشهای مختلفی بهره گرفته میشود. این روشها را میتوان بهصورت عمده به دو گروه وابسته به کشت و غیروابسته به کشت تقسیمبندی کرد. در روشهای وابسته به کشت یا culture-dependent approaches از انواع محیط های کشت و بهویژه انواع افتراقی استفاده میشود و بر اساس تفاوت واکنش میکروارگانیسم خالص در محیط به شناسایی آن پرداخته میشود. برای این منظور جداول و دستورالعملهای بسیاری در دسترس محققان وجود دارد. یکی از معروفترین و البته معتبرتریــن دستــــورالعمـــلهای شناســــــایی باکتــــریها کتاب چهار جلدی برگی[۲] میباشد.
نگهداری: درنهایت پس از جدا کردن یک میکروارگانیسم خاص از یک نمونه میتوان آن را جهت هرگونه آزمایش بعدی در آزمایشگاه نگهداری نمود. برای این منظور از روشهای مختلفی استفاده میشود؛ بهعنوان مثال برای نگهداری کوتاهمدت باکتری میتوان آن را روی سطح محیط کشت تریپتیک سوی آگار[۳] یا بهصورت مختصر TSA که بهصورت سطح شیبدار[۴] تهیه شده است کشت داد و در یخچال نگهداری کرد. برای نگهداری طولانیمدت باکتری نیز میتوان از کشت غلیظ باکتری در محیط کشت Skim Milk استفاده کرد. روش دیگر نگهداری باکتری برای مدت طولانیتر انتقال کشت غلیظ باکتری در حجم مساوی از گلیسیرین استریل شده در یک میکروتیوب است. این میکروتیوب محتوی سلول باکتری را در دمای ۸۰- درجه سانتیگراد در فریزرهای مخصوص تا مدت طولانی میتوان نگهداری کرد. برای نگهداری باکتری برای مدتهای بسیار زیاد اغلب روش لیوفیلیزه کردن[۵] انجام میشود. در این روش کشت باکتری در خلأ و دمای پایین آبگیری میشود و درنهایت از باکتری پودری بدست میآید که در ویالهای کوچکی که بدون در بوده و سر آنها ذوب شده است، قابل نگهداری تا زمان بسیار طولانی میباشند.
دستورالعمل کلی ساخت انواع محیط کشت
محیط های کشت به سه دسته جامد، نیمهجامد و مایع تقسیم میشوند. محیطهای مایع معمولاً فاقد آگار هستند یا مقدار آگار در آنها بسیار کم است. محیطهای نیمهجامد دارای مقدار کمی آگار؛ حدود ۳- ۲ گرم در هر لیتر محیط کشت و محیطهای جامد دارای ۱۰ تا ۱۵ گرم آگار در هر لیتر از محیط کشت هستند. برای ساختن محیط های کشت باکتریایی، از پودر مخصوص که در ظرف مربوطه قرار دارد، استفاده میکنیم. در روی این شیشهها ترکیب محیط بهطور کامل و همچنین طرز ساختن آن نوشته شده است. ابتدا مقدار لازم از پودر وزن شده و در مقدار معینی آب مقطر که قبلاً در یک ارلن مایر یا ظرف مناسبی ریخته شده است اضافه میشود و آن را کاملاً حل مینمائیم و سپس با پنبه درب ارلن مایر را مسدود کرده و آن را روی سهپایه چراغ گازی یا ماکروویو حرارت میدهیم. در زمان جوشیدن آن را چند بار تکان میدهیم تا خوب حل شود و بمدت یک دقیقه میجوشد. پس از آنکه مایع بجوش آمد و ذرات معلق و نامحلول دیده نشد، آن را از حرارت دور کرده و با فویل آلومینیومی روی پنبه را پوشانده و ظرف در دستگاه اتوکلاو قرار میگیرد تا در فشار ۱۵ پوند بر اینچ مربع و حرارت ۱۲۱ درجه سانتیگراد به مدت ۱۵ دقیقه استریل شود. بعد از اتمام این مرحله اجازه میدهیم تا محلول محیط کشت خنک شود. زمانی که دمای آن به حدود ۴۰ تا ۵۰ درجه سانتیگراد رسید درحالیکه ارلن را در دست راست گرفته و پنبه آن را با دست چپ کنار شعله خارج کردهایم دهانه ارلن را یکبار از درون شعله عبور میدهیم و بعد درون پلیتهای استریل، ۱۵ تا ۲۰ میلیلیتر از محلول مایع محیط کشت را میریزیم. در ادامه در کنار شعله به پلیتها استراحت میدهیم تا سرد شوند و از تکان دادن و جابهجایی بیمورد آنها خودداری مینمائیم. پس از جامد شدن محیطهای کشت، آنها را جمع کرده و در ۳۷ درجه سانتیگراد بهمدت ۲۴ ساعت قرار میدهیم. اگر محیطها آلوده نشده باشند آنها را در یخچال ۴ درجه سانتیگراد قرار میدهیم.
طرز ساختن سایر محیط های کشت نیز همینطور میباشد، منتهی بعضی از محیطهای جامد پس از جوشاندن در لولههای آزمایش ریخته شده و سپس استریل میشوند که این محیطها را پس از استریل شدن، یا بهطور ایستاده و صاف قرار میگیرند مانند محیط SIM و یا بهصورت شیبدار همانند محیط TSI تا خنک شوند.
برای ساختن محیط مایع (براث) پس از جوشاندن، محیط را در ارلن یا در لولههای آزمایش تقسیم میکنیم و سپس با پنبهای درب آنها را مسدود کرده و جهت استریل داخل اتوکلاو قرار میدهیم.
آشنائی با تعدادی از رایجترین محیط های کشت که در آزمایشگاههای میکروب شناسی مورد استفاده قرار میگیرند:
۱- محیط کشت مولر هیلتون آگار[۶]
این محیط کشت برای آزمون حساسیت میکروارگانیسمهای بیماریزا به مواد آنتیبیوتیکی و سولفانامیدها در نمونههای کلینیکی بر طبق متد Kirby-Baver و Ericsson توصیه شده است. این محیط بهعنوان یک محیط مغذی پایه، برای بررسی آنتیبیوگرام مناسب است. مولر هینتون آگار، محتوی Infusion حیوانی، کازامینو اسیدها[۷] و نشاسته است، همچنین این محیط کشت کاملاً فاقد آنتاگونیستهای سولفونامیدی میباشد. این محیط میتواند رشد بیشتر ارگانیسمها را تقویت کند.
وجود نشاسته در این محیط باعث ایجاد خاصیت بافری در آن میشود، در نتیجه میتواند تا حدودی در برابرتغییرات PH مقاومت کند؛ همچنین بعضی از باکتریها متابولیتهایی را تولید میکنند که جلوی فعالیت آنتیبیوتیکها را میگیرد که نشاسته آنها را حذف میکند. در مولر هینتون املاحی مثل ca و mg غلظتشان برابر غلظت بدن است، مهارکننده برای بعضی آنتیبیوتیکها را ندارد و غلظت بازهای تیمین و تیمینین در آن مشخص است.
۲- محیط کشت ائوزین متیلنبلو آگار[۸]
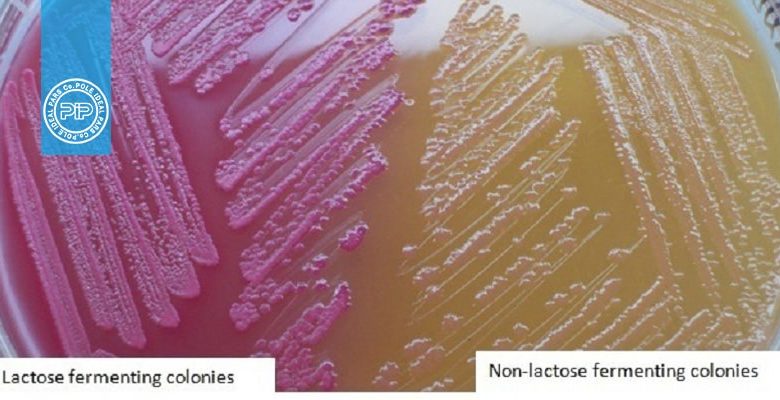
محیط کشت باکتریایی ائوزین متیلنبلو دارای قند لاکتوز و نمکهای صفراوی (ائوزین و متیلنبلو) بهعنوان مهارکننده میباشد که این محیط در صورت رشد باکتری مصرف کنندهی لاکتوز، کلنی صورتی رنگ ایجاد میکند. اگر کلنی بیرنگ ایجاد نماید، لاکتوز مصرف نشده است، از این رو این محیط یک محیط کشت افتراقی باکتریها بر اساس مصرف یا عدم مصرف لاکتوز بشمار میرود. محیط کشت EMB یا ائوزین متیلنبلو آگار یک محیط افتراقی و انتخابی است.
مشخصه ویژه محیط کشت EMB جلای فلزی باکتری Ecoli بر روی آن است. از این رو محیط کشت EMB آگار یک محیط کشت اختصاصی برای باکتری Ecoli به شمار میرود.
- باکتریهای گرم منفی انتروباکتریاسه، مانند ایکولای و انتروباکتر آئروزنس لاکتوز را تخمیر میکنند.
- کلونیهای ایکولای در محیط EMB دارای جلای فلزی سبز رنگ هستند.
- انتروباکتر آئروزنس در این محیط کلنیهای صورتی رنگی ایجاد میکند که گاهی دارای نقاط بنفش در مرکز آنها (چشم ماهی) هستند.
باکتری های گرم منفی پروتئوس ولگاریس و سالمونلا تیفیموریوم در محیط EMB رشد میکنند اما قند لاکتوز را تخمیر نمیکنند.
۳- محیط کشت بلاد آگار[۹]
محیط کشت بلاد آگار (ژلوز خوندار) یک محیط کشت عمومی دارای اغلب ترکیبات مغذی برای رشد باکتریها است. این محیط، یک محیط بسیار غنی برای رشد باکتریهای سختگیر مانند استرپتوکوکوسها بهحساب میآید. از این محیط بهمنظور جداسازی و تکثیر باکتریهای سخترشد و باکتریهای بیماریزا که برای رشد به مواد مغذی نیاز دارند، استفاده میشود. استرپتوکوکها بر روی محیط معمولی بهراحتی قادر به رشد نیستند اما در محیط بلاد آگار بهخوبی رشد میکنند، بعلاوه با استفاده از این محیط وجود آنزیم همولیزین در باکتریها را میتوان بررسی کرد. گفتنی است بر اساس مورفولوژی کلنی باکتریایی بر روی محیط کشت آگار خوندار میتوان نوع باکتری را تشخیص داد. این محیط از یك محیط پایه مانند تریپتون كه منشأ پروتئینی دارد، كلرید سدیم آگار و ۵ درصد خون تشكیل شده است.
برای ساخت این محیط بایستی محیط کشت تریپتیک سوی آگار (Tryptic soy agar) را با ۵ درصد خون دفیبرینه گوسفندی مخلوط نمود. به این منظور پس از اتوکلاو محیط پایه، در دمای در حدود ۵۰ درجه، خون دفیبرینه گوسفندی را به نسبت ۵ تا ۷ درصد به محیط پایه اضافه نموده و با رعایت شرایط استریل در پلیتهای استریل میریزیم. یکی از مهمترین مراحل ساخت این محیط، دمای محیط در لحظه افزودن خون است، زیرا درصورتیکه دمای محیط در این زمان بالا باشد، گلبولهای قرمز شکسته شده و محیط کشت شکلات آگار ایجاد میگردد.
البته باید توجه داشت که خون، مهارگر رشد برخی باکتریها نیز میباشد و بعضی از باکتریها در بلاد آگار قادر به رشد نیستند؛ اما اگر باکتری همولیز داده باشد نشانه پاتوژن بودن آن است. انواع همولیز در محیط بلاد آگار شامل موارد زیر می باشد.
- آلفا: لیز ناقص در محیط
- بتا: لیز کامل در محیط
- گاما: عدم لیز در محیط
۴- محیط کریبلر[۱۰]
محیط کشت کریبلر یک محیط انتقالی جهت انتقال نمونههای بیماران میباشد. این محیط (pH=8.4)، محیط انتقال مناسب برای بسیاری از عوامل بیماریزای رودهای میباشد.
رنگآمیزی گرم[۱۱]
معروفترین نوع رنگآمیزی مرکب نوع گرم میباشد. این روش مفیدترین روش تشخیص باکتریها میباشد. میکروبشناسی دانمارکی بنام هانس کریتستیان گرم در سال ۱۸۸۴ بهطور تصادفی واکنشی را کشف کرد که بعدها واکنش رنگآمیزی گرم نامیده شد. بر این اساس، باکتریها با توجه با ساختمان دیواره یاختهای (سلولی) به دو بخش بزرگ و کلی تقسیم میشوند: باکتریهای گرم مثبت و گرم منفی. تفاوت عمده بین این دو گروه تفاوتهای ساختاری (ساختمانی) بین این دو گونه میباشد؛ به این ترتیب که در گونه گرم مثبتها در دیواره سلولی نوعی پلیساکارید بکار رفته و دیواره سلولی آن کمی ضخیمتر میباشد، درصورتیکه در دیواره سلولی نوع گرم منفی مقدار چربی بیشتری بکار رفته و دیواره سلولی آن کمی نازکتر از نوع گرم منفی میباشد. در رنگآمیزی گرم، باکتریهای گرم مثبت پس از رنگآمیزی به رنگ بنفش و باکتریهای گرم منفی به رنگ قرمز مشاهده میشوند. بر همین اساس در رنگآمیزی گرم با توجه به این تفاوت مهم در دیواره سلولی، از دو نوع رنگ استفاده میشود، رنگ اولیه کریستال ویوله میباشد. هنگامی که محلول کریستال ویوله به گسترش باکتریایی اضافه میشود این رنگ با ریبونوکلئات موجود در دیواره سلولی ترکیب شده و کمپلکس کریستال ویوله–ریبونوکلئات را بوجود میآورد و بعد از شستشوی رنگ اضافی، محلول ید را بکار میبرند. این محلول ید که ترکیبی فلزی میباشد به رنگ متصل شده و یک ترکیب رنگی غیرمحلول ایجاد میکند بنام کمپلکس کریستال ویوله–ید که در سر دیگر آن متصل شده به ریبونوکلئات موجود در دیواره سلولی و تشکیل کریستال ویوله–ید–ریبونوکلئات داده است، درحالیکه در باکتریهای گرم منفی چنین کمپلکسی ایجاد نمیشود. این پیوند در باکتریهای گرم مثبت بسیار پایدار است و در مرحله بعدی توسط ماده رنگبر شکسته نمیشود و رنگ بنفش کریستال ویوله را در خود حفظ کرده، بنابراین باکتریهای گرم مثبت زیر میکروسکوپ بنفش رنگ دیده میشوند.
از طرفی در دیواره سلولی باکتریهای گرم منفی مقدار چربی بیشتری بکار رفته است، بنابراین چربیها در الکل استن که در مرحله بعدی بهعنوان رنگبر بکار میرود، محلول هستند و در اثر این واکنش چربیها از دیواره سلولی خارج شده و در اثر شستشو با حلال رنگبر، رنگ کریستال ویوله هم از سطح باکتری خارج میشود. با خروج چربی توسط ماده رنگبر، بر اندازه منافذ دیواره سلولی افزوده شده که این امر باعث بیرنگ شدن سریع باکتریهای گرم منفی میشود. در این مرحله باکتریهای گرم منفی از کریستال ویوله پاک میشوند؛ بنابراین بعد از شستشو توسط آب و افزوده شدن رنگ دوم یعنی سافرانین (فوشین)، این رنگ به دیواره سلولی باکتریهای گرم منفی جذب شده و باکتریها به رنگ قرمز درمیآیند و در بررسی میکروسکوپی، باکتریهای گرم منفی به رنگ قرمز دیده میشوند.
روش انجام کار:
- تهیه گسترش روی لام: ابتدا از نمونه باکتری یک گسترش روی لام تهیه میشود.
- رنگآمیزی با کریستال ویوله: در این مرحله مقداری از رنگ کریستال ویوله با قطرهچکان به روی سطح گسترش میکروبی روی لام ریخته میشود و یک دقیقه استراحت داده میشود تا رنگ در دیواره سلولی میکروبها نفوذ کند.
- مرحله شستشو: پس از سپری شدن مدت زمان ۱ دقیقه، رنگ اضافی روی لام را خالی کرده و با استفاده از آب مقطر سطح روی گسترش شستشو میشود.
- مرحله اضافه کردن محلول ید: چند قطره از محلول ید را روی گسترش پخش نموده و اجازه داده میشود بمدت ۱ دقیقه به همان حالت بماند. بعد محلول اضافی را خالی کرده و با آب مقطر لام را شستشو میشود.
- مرحله رنگبری با استفاده از استن–الکل: محلول رنگبر الکل–استن برروی گستره ریخته میشود. این مرحله در طول ۱۵ تا ۲۰ ثانیه انجام میگیرد. بعد از آن لام بهسرعت شسته میشود. این عمل، بیرنگ شدن را متوقف خواهد کرد.
- رنگآمیزی با سافرانین: در این مرحله سطح گسترش با رنگ ثانویه یعنی سافرانین پوشانده شده و ۳۰ تا ۶۰ ثانیه برای رنگپذیری زمان داده میشود. بعد از آن رنگ اضافی را خالی کرده و با آب مقطر لام را شستشو میدهیم.
- لام رنگآمیزی شده را آهسته روی کاغذ خشککن قرار داده ولی کاغذ روی گسترش کشیده نمیشود. نمونه، آماده بررسی در زیر میکروسکوپ است.
مروری بر رایجترین آزمونهای بیوشیمیائی برای شناسائی آنتروباکتریاسه ها
محیط کشت تریپل شوگر آیرون[۱۲]
این محيط بهطور گسترده در تشخيص باکتریهای رودهای (اعضای خانواده انتروباكترياسه) كاربرد دارد كه بهصورت شیبدار در لوله آزمايش ساخته میشود و در نتیجه سطح بيشتري براي رشد باکتریها فراهم میشود. كشت در محيط جامد بهصورت عمقی سطحی انجام میگیرد. محیط TSI باید ۳ سانتیمتر عمق و ۳ سانتیمتر سطح داشته باشد.
محيط TSI حاوی معرف فنلرد، سولفات فرو، تيوسولفات سديم (براي تشخيص توليد گاز سولفيد هيدروژن) و سه قند گلوکز، لاكتوز و سوكروز است كه غلظت گلوكز در محیط، ۰/۱ غلظت دو قند ديگر میباشد. بعبارت دیگر میزان لاکتوز و سوکروز ۱۰ برابر گلوکز است. همهی باکتریهای خانواده انتروباکتریاسه گلوکز را تخمیر میکنند. در ۶ ساعت اول کشت سطح و عمق محیط زرد میشود ولی بعدا اگر باکتری از لاکتوز یا سوکروز و یا هردو استفاده کند تولید اسید ادامه یافته و اندیکاتور ph فنل رد رنگ زرد را نشان میدهد و سطح و عمق محیط زرد رنگ خواهد شد. در صورتیکه از کربوهیدراتهای لاکتوز و سوکروز استفاده نشود باکتری از پپتون محیط استفاده کرده و شکستن پپتون نیاز به اکسیژن دارد که در سطح انجام میشود و حاصل آن نیز آمینهای قلیائی است، لذا سطح محیط قرمز میشود.
دامنه ph محيط از ۶/۸ تا ۸/۴ متغير میباشد. اين محيط قبل از كشت به دليل داشتن معرف فنلرد قرمز رنگ است. این محیط یک محیط کشت سهکاره است یعنی میتوانیم سه تست افتراقی را با این لوله انجام میدهیم.
- تخمیر لاکتوز
- تولید H2S
- تولید گاز (مثل N2و H2و…)
تخمیر لاکتوز: یک تست بسیار مهم و کلیدی برای تفریق گونههای آنتروباکتریاسهها از یکدیگر است.
نتایج حاصل از این تست را بهصورت کسر بیان میکنند که در این فرم صورت کسر مربوط به سطح (slant) و مخرج کسر مربوط به قسمت استوانهای لوله (عمق) میباشد.
- اگر Acid/Acid شد یعنی هم slant (صورت) و هم استوانه (مخرج) زرد رنگ شدهاند، نتیجه میگیریم که باکتری قدرت تخمیر گلوکز و لاکتوز را دارد.
- اگر Alk/Alk شد یعنی هم slant (صورت) و هم استوانه (مخرج) قرمزرنگ شدهاند، نتیجه میگیریم که باکتری قدرت تخمیر هیچیک از دو قند گلوکز و لاکتوز را ندارد.
- اگر Alk/Acid شد یعنی slant (صورت) قرمز رنگ شد ولی استوانه (مخرج) زرد رنگ است؛ نتیجه میگیریم که باکتری قدرت تخمیر گلوکز را دارد ولی قدرت تخمیر لاکتوز را ندارد.
تولید H2S: معرف این تست سولفات آهن است. سولفات آهن درصورتیکه با H2S ترکیب شود ترکیبی سیاه رنگ میدهد، پس چنانچه باکتری +H2S باشد رسوبی سیاه رنگ را در لوله مشاهده میکنیم.
تولید گاز: بعضی از باکتریها در مسیرهای متابولیکی خود گازهایی از قبیل N2 و H2 تولید میکنند. اگر محیط از لحاظ شکل سالم بود؛ تولید گاز منفی است ولی اگر محیط تکهتکه و حفره شده بود تولید گاز مثبت است. در مواردی یک حباب بزرگ مشاهده میکنید که بیانگر تولید فراوان گاز بوده است.
مطالب ذکرشده را میتوان بهصورت زير خلاصه نمود:
- سطح زرد/ عمق زرد، گاز مثبت، H2s منفی
- سطح زرد/ عمق زرد، گاز مثبت، H2s مثبت
- سطح قرمز/ عمق زرد، گاز مثبت، H2s مثبت
- سطح قرمز/ عمق زرد، گاز منفي، H2s مثبت
- سطح قرمز/ عمق قرمز، گاز منفي، H2s منفي
باسیلهای گرم منفي را بر اساس واكنش ایجادشده بر روی اين محيط میتوان به پنج گروه تقسيم كرد:
در گروه i تخمير گلوكز، لاكتوز، سوكروز، منتهي به اسيدی شدن (زرد شدن) تمامی محيط و توليد گاز میگردد.
هنگامیکه عمق و سطح اين محيط توسط باکتریهای گروه iv ,iii كشت داده میشود، باكتری كشت دادهشده ابتدا بهطور هوازی و سپس به طریقه بیهوازی شروع به مصرف گلوكز مینمايد. زمانی كه هر دو طريقه در حال انجام است (ساعات اوليه انكوباسيون) ph تمامی نقاط محيط كشت اسيدی و در نتيجه محيط زرد رنگ است اما از آنجايی كه تخمير هوازی در مقايسه با تخمير بیهوازی با سرعت بيشتری بوقوع میپیوندد، گلوكز موجود در سطح به پايان رسيده و باکتریها شروع به تجزيه پپتون موجود در محيط مینمایند. از تجزيه پپتون در شرايط هوازی، بیهوازی، آمونياك (Nh3) توليد میشود. محصولات اين عمل خاصيت قليايی داشته و در نتيجه رنگ سطح محيط مجدداً قرمز میشود. در همین حال عمق محيط به دلیل سیر آرامتر تخمير بیهوازی گلوكز، همچنان اسيدی و زرد رنگ باقی میماند.
گروه v باسیلهای گرم منفی، غيرتخمیرکننده مانند گونههای سودوموناس، پپتونهای موجود در محيط را تجزيه كرده و سطح و عمق محيط را بدون توليد گاز، قرمز رنگ مینمایند.
روش انجام کار:
با استفاده از آنس سوزنی استریل خنک، نمونه باکتری را از مرکز یک کلونی که بهتازگی روي پلیت محیط مورد استفاده برای کشت انتروباکتریاسه رشد کرده است، به سطح شیبدار TSI Agar انتقال میدهیم و آن را با حرکت آنس در امتداد سطح شیبدار، کشت میدهیم و سپس عمق را با سوراخ کردن محیط، تلقیح مینماییم. لولهها را با درپوشهای شلشده به مدت ۲۴-۱۸ ساعت در دماي ۳۷ درجه سانتیگراد در اتمسفر هوازي انکوبه میکنیم.
تست فنیل آلانین دآمیناز
فنیل آلانین اسیدآمینهای است كه ضمن دآمنیه شدن به فنیل پیروویك اسید تبدیل میشود، این اسید با افزودن كلرورفریك ۱۰% و ایجاد رنگ سبز مشخص میشود. این آزمون در تشخیص پروتئوس، مورگانلا و پروویدنسیا از سایر باکتریهای گرم منفی کمک میکند.
مراحل انجام كار:
۱- در لوله حاوی محیط فنیلآلانین آگار، سطح محیط کشت را با كلنی ایزوله تلقیح کرده و در لوله بهصورت شل بسته میشود.
۲- لوله آزمون به مدت ۱۸ تا ۲۴ ساعت در دمای ۳۵ درجه سانتیگراد انکوبه میشود.
۳- چهار تا پنج قطره كلرورفریك ۱۰% مستقیماً به سطح آگار اضافه میکنیم؛ لوله را میچرخانیم تا کلنیها در آن غوطهور شوند.
ظهور بلافاصله رنگ سبز بعد از ریختن معرف، بیانگر مثبت بودن این تست است.
تست MR/VP (متیل رد و وژ پروسکوئر)
تست MR/VP يكی از تستهای تشخيصی باکتریهای انتروباكترياسه میباشد. این آزمون جهت بررسی محصول نهایی تخمیر باکتریها استفاده میشود. محیط MR/VP دارای قند گلوکز و فسفات دیپتاسیک است. تمام اعضای انتروباکتریاسه توانایی تخمیر قند گلوکز را دارند البته از دو راه مختلف؛ یکی مخلوط اسیدی و دیگری تخمیر الکلی. برای تشخیص باکتریهای تولیدکننده مخلوطی از اسیدها در تخمیر مخلوط اسیدی (شامل اسید لاکتیک، اسید سوکسینیک و اسید فرمیک که از گلوکز موجود در محیط MR.VP حاصل میشوند) از محیط متیل رد (MR) استفاده میشود که بیرنگ میباشد. در مسیر دیگر از تخمیر قند گلوکز، بوتیلن گلایکول تولید میشود:
بوتیلن گلایکول→استوئین→اسید پیروئیک→گلوکز
در این صورت میزان اسیدیته محیط پایین است و از معرف VP استفاده میشود. در این حالت MR منفی است. باکتریهایی مانند كلبسیلا، انتروباكتروسراشیا میتوانند تولید استوئين نمایند، درحضور اكسیژن هوا و هیدروکسید پتاسیم ۴۰ درصد، استوئين به دياستیل تبدیل میشود و آلفانفتول بهعنوان یك كاتالیزور عمل نموده و تولید رنگ قرمز مینماید. معرف VP از دو بخش آلفا نفتول ۵% و هیدروکسید پتاسیم ۴۰% تشکیل شده است.
مراحل انجام كار:
۱- ابتدا باکتری را در محیطMR-VP کشت میدهیم.
۲- لوله آزمایش را به مدت ۲۴ ساعت در ۳۷ درجه سانتیگراد انکوبه میکنیم.
۳- پس از طی شدن زمان انکوباسیون، مخلوط باکتری و محیط کشت را در دو لوله مجزا تقسیم میکنیم.
۴- معرف قرمز رنگ MR را قطرهقطره به داخل کشت یکی از لولهها افزوده و واکنش ایجادشده را بررسی مینماییم. درصورتیکه تخمیر از راه مخلوط اسیدی باشد معرف رنگ خود را در PH اسیدی حفظ میکند، در غیر این صورت رنگ قرمز معرف بیرنگ میگردد.
۵- در لولهی دیگر به ازای cc 2/5 کشت، شش قطره آلفا نفتول و دو قطره پتاس ۴۰% به محیط اضافه میشود، محیط را تکان داده و در دمای آزمایشگاه به مدت ۲۰ دقیقه بدون حرکت قرار میدهیم. پس از این مدت اگر باکتری VP مثبت باشد در سطح محیط کشت رنگ نارنجی ظاهر میگردد.
محیط SIM
محیطی نیمه جامد است و همانطور که از اسمش مشخص است برای تعیین تولید SH2، اندول و حرکت باکتری به کار می رود.
نحوه کشت دادن در محیط
از آنجایی که از این محیط برای شناسایی حرکت در باکتری به کار گرفته می شود، در هنگام کشت دادن باید دقت شود که یک خط کشت از آن ایجاد گردد. برای اینکار با آنس از کلنی باکتری خالص و ایزوله شده نمونه گرفته به آرامی در عمق محیط فرو کرده و بدون لرزش دست از محیط خارج مینماییم. جهت مشخص کردن حرکت باکتری در این محیط بعد از انکوباسیون و رشد باکتری به خط کشت نگاه کرده دور شدن باکتری از خط کشت نشانه حرکت در باکتری است و چنانچه فقط خط کشت کدر شود نشانه عدم حرکت در باکتری است.
۱- چنانچه در هنگام کشتدادن به واسطه لرزش دست صفحه کشت به جای خط کشت ایجاد شود از آن محیط برای شناسایی حرکت نمیتوان استفاده کرد.
۲- در باکتریهای هوازی اجباری چون این باکتریها در عمق محیط قادر به رشد نمیباشند معمولا در سطح محیط و در نقطه کشت رشد کرده در نتیجه در باکتریهای هوازی اجباری که دارای حرکت باشند حرکت آن با دور شدن از نقطه کشت در سطح محیط کشت مشخص میگردد.
۳- برخی باکتریها در محیط SIM با احیای مواد آلی گوگرد دار SH2 تولید می کند که سبب سیاه شدن محیط کشت میگردد.
۴- ممکن است یک باکتری در محیط TSI تولید SH2 کرده اما در SIM تولید SH2 نکند و بالعکس.
چگونگی شناسایی تولید اندول در محیط SIM : بعد از انکوباسیون و رشد باکتری از معرف کواکس یا ارلیش استفاده میشود. چانچه بعد از اضافه کردن معرف کواکس حلقه قرمز رنگ در روی محیط ایجاد شود نشانه اندول مثبت بودن باکتری است. در صورتی که باکتری دارای آنزیم تریپتوفاناز باشد میتواند از اسید آمینه تریپتوفان، اندول، اسکاتول و استیک اسید تولید کند. برای بررسی اندول از معرف کواکس یا ارلیخ ( پارا دی متیل آمینو بنزآلدئید) استفاده میشود که در اثر واکنش اندول با عامل آلدئیدی کمپلکس قرمز رنگ ایجاد میشود.
تولید SH2: مانند سایر محیطهای ذکر شده برای بررسی تولید SH2 از تایوسولفات سدیم و سیترات آمونیوم فریک موجود در محیط کشت استفاده شده است. ایجاد رسوب سیاه در محیط شفاف SIM نشان دهنده تولید SH2 است.
تست اندول
اندول توسط بعضی از میکروارگانیسمهای معین در تریپتون براث تولید میشود. تریپتون براث غنی از اسیدآمینه تریپتوفان است که توسط این باکتریها بهعنوان منبع کربن و نیتروژن و انرژی استفاده میشود. ارگانیسمهایی كه دارای آنزيم تريپتوفاناز هستند قادر به تجزيه اسیدآمینه تريپتوفان به اسيد پيرويك، آمونياك و اندول میباشند. اندول بهوسیله تركيب با معرف آلدئيد و تشكيل يك محصول رنگي شناسایی میشود. همه باکتریها و حتی همه باکتریهای رودهای گرم منفی قادر به مصرف تریپتوفان و تولید اندول با این روش نیستند؛ بنابراین تولید اندول میتواند یک روش تشخیصی باشد. اين آزمايش جهت تمايز گونههای پروتئوس كه داراي سوارمينگ هستند از ساير گونهها و تشخيص احتمالی اشريشياكولی مورد استفاده قرار میگیرد. همچنين اين آزمايش جهت ارگانیسمهای بیهوازی نيز ممكن است مفيد باشد. اندول، كه محصول نهائی تجزيه تريپتوفان بهوسیله آنزيم تريپتوفاناز میباشد را میتوان بهوسیله توانائی تركيب آن با برخی از آلدئيدها و تشكيل يك ماده رنگی مشخص نمود. اندول در مجاورت سينامالدئيد تغيير رنگ سبز– آبی ايجاد میكند.
مراحل انجام كار:
- يك قطعه كاغذ صافي مناسب (واتمن شماره ۱) را در كف يك پلیت قرار داده و آن را با معرف اندول اشباع نمایید.
- با استفاده از لوپ يا يك ميله چوبي، مقداری از كلني را بر روی سطح كاغذ صافی بماليد. اگر بلافاصله تغيير رنگ آبی مشاهده شد بيانگر يك آزمايش مثبت است. بيشتر ارگانیسمهای اندول مثبت در مدت ۳۰ ثانيه رنگ آبی را ايجاد میکنند.
آزمون مصرف سیترات[۱۳]
سديم سيترات، نمك اسيد سيتريك و يك تركيب آلی است كه در سيكل كربن متابوليزه شده و میتواند منبع كربن محسوب شود. برخي از ارگانیسمها میتوانند انرژی موردنیاز خود را با استفاده از سديم سيترات بهعنوان تنها منبع كربن و از نمکهای آمونيوم غير ارگانيك بهعنوان تنها منبع نيتروژن بدست آورند. باکتریهایی که قادرند سیترات را بهعنوان تنها منبع کربن و انرژی و نمک آمونیوم را بهعنوان تنها منبع ازت جهت رشد خود به کار برند قادرند محیط سیمون سیترات (سبز رنگ) که حاوی معرف بروموتیمول بلو است را به رنگ آبی تبدیل کنند.
محيط سيمون سيترات آگار حاوي نمکها، کاتیونها، بافرهای سيترات و برومتيمول آبي بهعنوان انديكاتور است و میتواند در pH قليايي (بالاتر از ۷/۶) و در جريان توليد تركيبات قليايی (تركيبات آمونيوم) حاصل از مصرف سيترات توليد رنگ آبي در محيط نمايد. باید توجه کرد که هر محيطی كه برای تعيين استفاده از سيترات بكار میرود، بايد فاقد پروتئين و كربوهيدرات بهعنوان منابع ديگر كربن باشد.
مراحل انجام كار:
- مقدار خيلي كم از ارگانيسم موردنظر (۲-۱ كلنی ايزوله) را در سطح آگار شیبدار سيمون سيترات تلقيح میکنیم.
- به مدت ۴۸-۲۴ ساعت لوله را در ۳۷-۳۵ درجه سانتیگراد انكوبه مینماییم. ايجاد رنگ آبی نشاندهنده واكنش مثبت است.
تست اورهآز
اورهآز آنزيمي است كه بعضی از ارگانیسمها آن را توليد كرده و اوره را به دیاکسید كربن، آب و آمونياك هيدروليز میکنند. آمونياك در محلول به كربنات آمونيوم تبديل شده و باعث قليايی شدن محيط و بالا رفتن pH میشود. از این آزمون میتوان برای افتراق انتروباكترياسهها، افتراق بين گونههای بروسلا ، شناسايی گونههای مهمی نظير كورينهباكتريوم اورهآليتيكوم، هليكوباكترپيلوری، تشخيص مخمرهای كپسولدار و بهعنوان يك تست اضافی براي تشخيص بعضي كوكوباسيلهاي گرم منفی استفاده کرد.
مراحل انجام كار:
- محيط كشت Broth را با مقدار نسبتاً زيادی از کلنیهای ايزوله تلقيح میکنیم.
- لوله را به مدت ۴۸ ساعت در ۳۷ درجه سانتیگراد انكوبه مینماییم. ارگانیسمهایی كه اوره را سريع هيدروليز میکنند، در عرض ۲-۱ ساعت واكنش مثبت میدهند و سویههایی كه كمتر فعالند، به ۳ روز يا بيشتر انكوباسيون نياز دارند. ايجاد رنگ قرمز نشاندهنده واكنش قليایی و هيدروليز اوره میباشد.
تهیه استاندارد ۰/۵ مکفارلند
براي استاندارد کردن غلظت تلقيح، جهت آزمايش تعيين حساسيت آنتیبیوتیکی، بايد از استاندارد سولفات باريم (BaSo4) که برای تهيه آن به روش زير عمل میشود، استفاده نمود.
۰/۵ میلیلیتر از کلرور باريم (W/V BaCl2/H2O 1.175% ) 0.048 mol/L (BaCl2) را به ۹۹/۵ میلیلیتر اسید سولفوريک ۰٫۱۸ مول بر لیتر (%۱ V/V) اضافه میکنیم و با همزدن مداوم يک سوسپانسيون تهيه مینماییم.
چگالي صحيح استاندارد با تعيين جذب اين سوسپانسيون توسط اسپکتروفتومتر در کووت به قطر ۱سانتیمتر تعيين میشود. جذب نوری در ۶۲۵ نانومتر بايد بين ۰٫۰۸ تا ۰٫۱۳ باشد.
از سوسپانسيون حاصله ۶-۴ میلیلیتر در لولههای درپيچدار هماندازه یا لولههای سوسپانسيون باکتريايی ريخته میشود. درب لولهها محکم بسته شده و در دمای اتاق و درشرايط تاريكي نگهداری میشود. قبل از هر بار استفاده، استاندارد با ورتکس مکانيکی بهشدت به هم زده میشود تا کدورت يکنواختی بدست آيد. در صورت مشاهده ذرات بزرگ، استاندارد تازهای جايگزين میشود. استاندارد سولفات باريم، بايد بهصورت ماهانه جايگزين گرديده يا جذب آن اندازهگیری شود.
واژهنامه:
| Tryptic Soy Agar | [۳] | Bergey’s Manual of Systematic Bacteriology | [۲] | Isolation | [۱] |
| (Mueller Hinton Agar (MHA | [۶] | lyophilization | [۵] | Slant | [۴] |
| Blod Agar | [۹] | EMB | [۸] | Casamino acids | [۷] |
| Triple Sugar Iron Agar (TSI Agar) | [۱۲] | Gram staining | [۱۱] | Cary blair medium | [۱۰] |
| Citrate Utilization Test | [۱۳] |