ایمونوهیستوشیمی: اصول، نکات و نگاهی به آینده
ایمونوهیستوشیمی (IHC) یک تکنیک رنگآمیزی ضروری با سابقه طولانی است که امروزه برای تحقیقات مدرن و کاربردهای بالینی در حال ارتقا است.
ایمونوهیستوشیمی (IHC) یک روش آزمایشگاهی است که برای تشخیص آنتی ژنهای خاص در بافتها یا سلولها بر اساس تشخیص کمپلکس آنتی ژن-آنتی بادی استفاده میشود. یکی از ویژگیهای برجسته IHC در مقایسه با سایر تکنیکهای آزمایشگاهی این است که بدون از بین بردن ساختار بافت شناسی انجام میشود و به محققان امکان میدهد الگوی بیان آنتی ژن مورد نظر را در زمینه ریزمحیط ارزیابی کنند. در ادامه این مطلب قصد داریم مروری اجمالی بر ایمونوهیستوشیمی و کاربردهای آن داشته باشیم.
تاریخچه ایمونوهیستوشیمی
منشأ روشهای مدرن IHC به سال ۱۹۴۱ برمیگردد. زمانی که آلبرت کونز و همکارانش برای اولین بار یک روش رنگ آمیزی مستقیم را با استفاده از آنتی بادی های اولیه نشاندار شده با فلورسنت در بافت یخ زده توسعه دادند. این روش امکان تجسم آنتی ژنهای هدف را با یک میکروسکوپ نوری استاندارد فراهم میکند. از آن زمان، یک سری پیشرفتهای تکنولوژیکی از جمله استفاده از بافت ثابت شده با فرمالین، FFPE، روشهای بازیابی آنتی ژن و سیستمهای تشخیص پیشرفته برای تجسم کمپلکس آنتی بادی-آنتی ژن، ایمونوهیستوشیمی را به یک ابزار رایج و در عین حال ضروری در آزمایشگاه های تشخیصی و تحقیقاتی تبدیل کرده است.
کاربردهای رایج IHC
همانطور که در بخش مقدمه هم گفته شد، امروزه ایمونوهیستوشیمی به یک تکنیک کمکی ضروری تبدیل شده است که در آسیب شناسی آناتومیک و آزمایشگاههای تحقیقاتی پایه در سراسر جهان استفاده میشود. آسیب شناسان به طور معمول از IHC برای کمک به تشخیص و پیش آگهی بیماری و به عنوان یک عامل پیش بینی کننده برای پاسخ های درمانی استفاده میکنند.
بهعنوان مثال، تومورها به دلیل امضای مولکولی منحصر به فرد خود دارای نشانگرهای خاصی هستند. در نتیجه، آسیبشناسان از IHC برای تشخیص خوشخیم یا بدخیم بودن تومور، شناسایی انواع سرطانها مانند کارسینوم، سارکوم یا ملانوم و مشخص کردن منشأ تومور متاستاتیک استفاده میکنند. ایمونوهیستوشیمی همچنین میتواند برای طبقهبندی انواع مختلف سرطان مانند سرطان سلول سنگ فرشی ریه در مقابل آدنوکارسینوم استفاده شود. این طبقه بندیها مهم هستند. زیرا در هنگام تعیین مؤثرترین راه درمانی به پزشک کمک زیادی میکنند.
دانشمندان و پزشکان همچنین از IHC برای تعیین پیامدهای بیماری مانند مرحله و درجه سرطان و میزان پرخطر یا تهاجمی بودن آن استفاده میکنند. علاوه بر این، آسیب شناسان از IHC برای پیش بینی اینکه آیا سلولهای تومور به درمانهای خاصی مانند درمان غدد درون ریز برای سرطان سینه و پروستات پاسخ میدهند یا خیر، استفاده میکنند.
در تحقیقات پایه، دانشمندان از IHC برای مطالعه بی شمار فرآیندهای بیولوژیکی، از جمله تکثیر سلولی، مرگ و ترمیم سلولی، توسعه بافت و اندام، و تنظیم ژن استفاده میکنند.
پروتکل ایمونوهیستوشیمی: مراحل عمومی
ایمونوهیستوشیمی به طور سنتی یک پروتکل دستی است و هنوز هم روش انتخابی در اکثر آزمایشگاههای تحقیقاتی، یک روش پایه است. با این حال، اکثر آزمایشگاههای بالینی در مقیاس بزرگ اکنون پروتکلهای کاملاً خودکار را با استفاده از رنگآمیزیهای استاندارد اتخاذ کردهاند. صرف نظر از روش مورد استفاده، پروتکلهای IHC انجام شده بر روی بافت تثبیت شده با فرمالین (FFPE) به طور کلی مشابه هستند و میتوان آنها را به شرح زیر خلاصه کرد.
1- پارافین زدایی و آبرسانی مجدد بافت
۲- بازیابی آنتی ژن
۳- مسدود کردن (بلوک کردن بافت)
۴- انکوباسیون آنتی بادی اولیه
۵- انکوباسیون آنتی بادی ثانویه
۶- تجسم
۷- قرار دادن لامل
ملاحظات مهم حین رنگ آمیزی
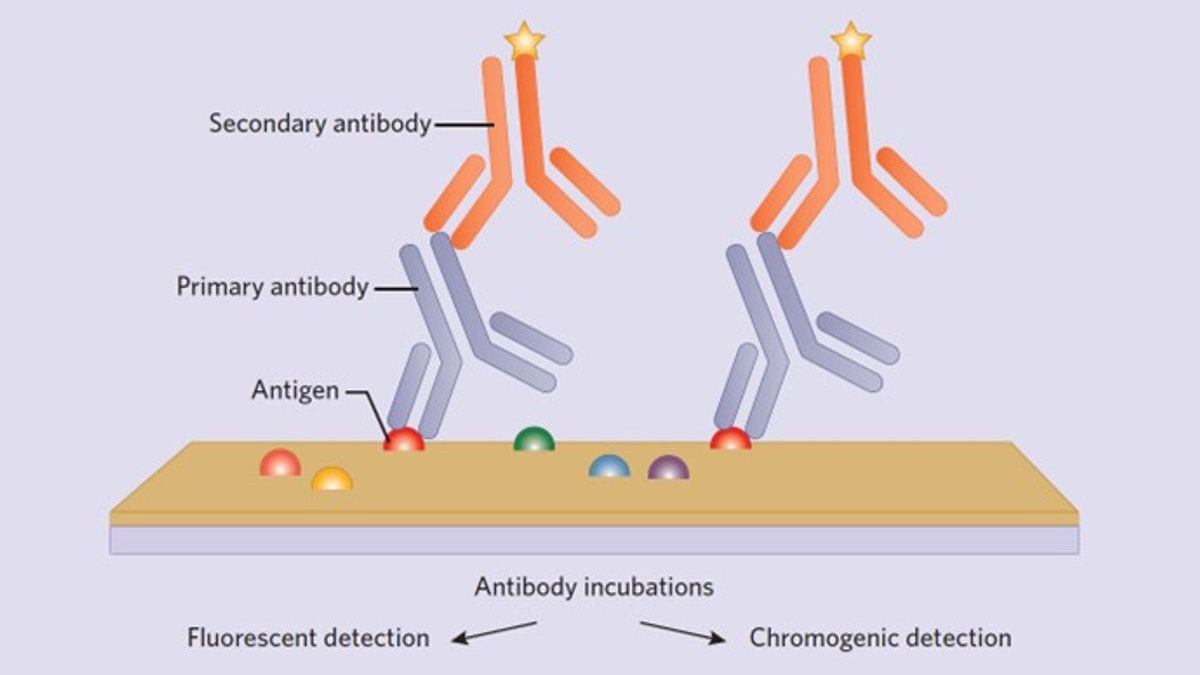
تمامی مراحل پروتکل IHC بر کیفیت نتیجه رنگآمیزی تأثیر میگذارد. اما سه عامل زیر اهمیت ویژهای در طول آمادهسازی اولیه دارند.
- انتخاب آنتیبادی اولیه
- بازیابی آنتیژن
- انتخاب سیستم تجسم.
انتخاب آنتیبادی اولیه
انتخاب آنتی بادی، مسلماً مهمترین مرحله است، زیرا آنتی بادیهای نامناسب منجر به رنگ آمیزی نامناسب میشوند. به طور کلی، آنتی بادیهای مونوکلونال به دلیل ویژگی بیشتر و قوام بهتر نسبت به به آنتی بادیهای پلی کلونال مناسبتر هستند.
بازیابی آنتیژن
در طول تثبیت بافت، فرمالین پیوندهای متیلن را بین آنتی ژنها و پروتئینهای نامرتبط مجاور ایجاد میکند که میتواند اتصال آنتی ژن-آنتی بادی را بطور فیزیکی مسدود کند. بازیابی آنتی ژن فرآیندی است که از طریق شکستن این پیوندهای عرضی، آنتی ژنها را از ماسک جدا میکند و به آنتیبادی اجازه میدهد تا به آنتیژن مورد نظر متصل شود. رایجترین روش بازیابی آنتی ژن در ایمونوهیستوشیمی ، استفاده از پروتکلهای مبتنی بر حرارت با بافرهای pH است که کمی بازی یا اسیدی هستند. اگرچه گزینههای پروتئولیتیک (آنزیمی) نیز موجود است. بهترین شرایط بازیابی آنتی ژن احتمالا برای هر آنتی بادی متفاوت خواهد بود و نیاز به آزمایش تجربی دارد. به طور سنتی، روشهای بازیابی pH پایینتر برای پروتکلهای دستی بهتر عمل میکنند.در حالی که پروتکلهای pH بالاتر در رنگآمیزیهای خودکار بهتر عمل میکنند.
انتخاب سیستم تجسم
افرادی که در آزمایشگاههای پاتولوژی تشخیصی کار میکنند به طور سنتی ترجیح میدهند از ارزیابی کروموژنیک یک آنتیژن منفرد که روی یک دستگاه رنگ آمیزی خودکار (autostainer) انجام میشود استفاده کنند. تقریبا تمامی سیستمهای رنگآمیزی خودکار از یک سیستم تشخیص مبتنی بر پلیمر با آنتیبادیهای کونژوگه به horseradish peroxidase (HRP) یا آلکالین فسفاتاز (AP) استفاده میکنند. این دو یک کروموژن قهوهای (HRP) یا قرمز (AP) در محل اتصال آنتی بادی تولید مینمایند. سیستمهای تشخیص پلیمری، حساسیت IHC را تا حد زیادی افزایش میدهند و زمان پروتکل را به میزان قابل توجهی کاهش میدهند. بهعلاوه، آنها به زمانهای برگشت بالا مورد نیاز هنگام تجزیه و تحلیل بافت بیمار در تنظیمات بالینی نیز کمک میکنند. به همین دلیل انتخاب یک سیستم تجسم در ایمونوهیستوشیمی اهمیت زیادی دارد. پروتکلهای IHC در آزمایشگاههای تحقیقاتی پایه عموماً به صورت دستی با هدف برچسبگذاری چندین آنتیژن به طور همزمان انجام میشوند. استاندارد فعلی برای این کار استفاده از آنتی بادیهای ثانویه برچسبدار فلورسنت است که هدف آن آنتیبادیهای اولیه مورد علاقه است تا با میکروسکوپهای فلورسنت یا کانفوکال قابل مشاهده باشند.
تفسیر نتایج IHC
اهمیت کنترلهای مناسب و درک نحوه استفاده از آنها در روشهای ایمونوهیستوشیمی اهمیت دارد. اما مواجهه با دادههای IHC مثبت کاذب و منفی کاذب در کاربردهای بالینی و تحقیقاتی امری کاملا رایج و طبیعی است. بنابراین دانشمندان باید هنگام تفسیر نتایج مراقب باشند.
یک نکته این است که به طور کامل واکنش پذیری ایمنی مورد انتظار (غشاء، هسته یا سیتوپلاسمی) آنتی ژن مورد نظر را درک کنید و مشاهده کنید که یک نتیجه مثبت واقعی عموماً ناهمگنی سلول به سلول را نشان میدهند. با این حال، بهترین راه برای تفسیر نتایج IHC. همیشه شامل کنترلهای مثبت و منفی مناسب در همان بافت میباشد.
نکات مهم برای رفع مشکلات رایج در ایمونوهیستوشیمی
یکی از سختترین سناریوها در IHC پرداختن به نتیجه ای است که ضعیف، تکه تکه یا فاقد سیگنال است. برای رفع این مشکل موارد زیر توصیه میشود:
- افزایش غلظت آنتی بادی اولیه
- افزایش زمان انکوباسیون
- تلاش برای یک پروتکل بازیابی آنتی ژن تهاجمیتر
دانشمندان همچنین میتوانند از روشهای تقویت سیگنال اضافی با استفاده از کیتهای موجود در بازار استفاده کنند.
یکی دیگر از مشکلات رایج در ایمونوهیستوشیمی، کمرنگ شدن ناخواستهی پس زمینه است. برای جلوگیری از بروز این مشکل راهکارهای زیر توصیه میشود:
- بلوک گیری بافت با ۵ تا ۱۰ درصد goat serum یا کازئین قبل از استفاده از آنتیبادی اولیه
- اضافه کردن ۰٫۵ میلیلیتر NaCl به رقیق کننده آنتی بادی اولیه
علاوهبراین، محققان باید زمانهای انکوباسیون خود را بهطور تجربی تعیین کنند، اما چنین استراتژیهایی معمولا نیاز به تجربه و کار دارد.
سخن پایانی: ایمونوهیستوشیمی در آینده

سرطان صرفاً یک بیماری ژنتیکی نیست، بلکه یک اکوسیستم پیچیده است که در آن تومورها در طیف وسیعی از فعل و انفعالات با سلولهای غیرسرطانی در ریزمحیط تومور (TME) درگیر هستند. در حال حاضر بیومارکرهای منفرد اغلب در ارائه تحلیلهای کمی و پیچیده از فعل و انفعالات شکست میخورند.
به همین دلیل، شرکتهای بزرگ بیوتکنولوژی در حال سرمایهگذاری روی رویکردهای IHC چندگانه با استفاده از کروموژنهای رنگی جدید برای بررسی مناظر پیچیده هستند. فناوری جدیدی به تازگی در دسترس قرار گرفته است که امکان برچسب گذاری دوگانه mRNA و پروتئین را به طور همزمان فراهم می کند. همزمان با پیشرفت تکنیکهای IHC، هوش مصنوعی برای تعیین کمیت و دیجیتالی کردن دقیق دادههای پیچیدهای که توسط این رویکردهای چندگانه در حال توسعه است. این پیشرفتها بدون شک در آیندهای قابل پیش بینی به ابزاری ارزشمند و نوآورانه برای آسیب شناسان تشریحی تبدیل خواهند شد.